
| A. | 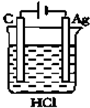 | B. | 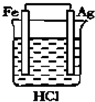 | C. | 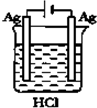 | D. | 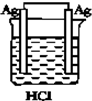 |
科目:高中化学 来源: 题型:解答题
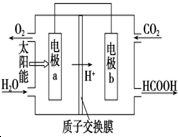 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,已知:
25℃时,已知:| A. | W 点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | pH=4 的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol•L-1 | |
| C. | pH=8 的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-) | |
| D. | pH=11 的溶液中:CO32-+H2O HCO3-+OH- K≈1.8×l0-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 微粒组 | 加人试剂 | 发生反应的离子方程式 |
| A | Fe3+、I-、Cr- | NaOH溶液 | Fe3++30H-═Fe(0H)3↓ |
| B | K+、NH3•H20、CO32- | 通人少量CO2 | 20H-+C02═CO32-+H20 |
| C | H+,Fe2+、SO42- | Ba(NO3)2溶液 | SO42-+Ba2+═BaSO4↓ |
| D | Na+、Al3+、Cl- | 少量澄淸石灰水 | Al3++30H-═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
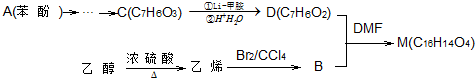
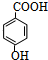

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
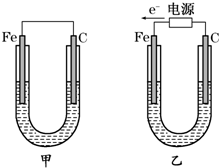
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①和②都是离子反应 | B. | 反应①和②都吸收热量 | ||
| C. | 反应①和②都放出热量 | D. | 反应③既不吸收热量也不放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含大量Al3+的溶液中:K+、Na+、NO3-、CO32-不能大量共存,因有Al2(CO3)3沉淀生成 | |
| B. | 含大量Fe3+的溶液中:K+Mg2+、I-、Br2-不能大量共存,因2Fe3++2I-=2Fe2++I2 | |
| C. | 由水电离的c(H+)=1×10-14mol/L的溶液中:Ca2+、NO3-、HCO3-、Cl-不能大量共存,因溶液呈酸性,与HCO3-反应产生CO2气体 | |
| D. | 在NH4Fe(SO4)2溶液中:Na+、K+、S2-、SCN-不能大量共存,只是因Fe3+和S2-反应产生淡黄色的S沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素都可用(C6H10O5)n表示,二者互为同分异构体 | |
| B. | Mg5(Si4O10)2(OH)2•4H2O的氧化物形式:5MgO•8SiO2•5H2O | |
| C. | Fe-2e-=Fe2+可表示钢铁析氢腐蚀和吸氧腐蚀的正极反应 | |
| D. | 乙醇分子的比例模型: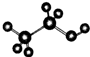 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com