

| ||
| ||
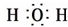 ,G为Na2CO3,H为NaHCO3,除去Na2CO3固体中含有NaHCO3杂质可采用加热的方法,使NaHCO3受热生成Na2CO3,
,G为Na2CO3,H为NaHCO3,除去Na2CO3固体中含有NaHCO3杂质可采用加热的方法,使NaHCO3受热生成Na2CO3,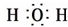 ;加热;
;加热; NH3?H2O+H+;
NH3?H2O+H+;| 1 |
| 2 |
| 2.8×10-9 |
| 1×10-4 |


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
| A、1.8g氧-18气体的物质的量是0.1mol |
| B、0.1mol重氧气体的体积是2.24L |
| C、重氧气体的摩尔质量为36g |
| D、0.1mol重氧水所含中子数约是6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
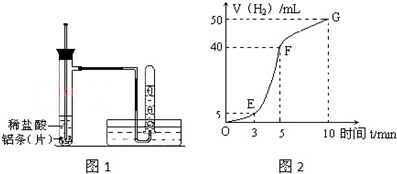
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )
某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )| A、乙中导气管里形成一段水柱 |
| B、乙中导气管中产生气泡 |
| C、金属片剪口处溶液变红 |
| D、锌被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50mL0.55mol?L-1 NaOH溶液 | 50mL0.5mol?L-1 HCl溶液 | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol?L-1 NaOH溶液 | 50mL0.5mol?L-1 HCl溶液 | 20℃ | 23.5℃ | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com