
分析 (1)铜跟浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水;
(2)浓硫酸具有强氧化性能够氧化铜,稀硫酸不具有强的氧化性,所以不能氧化铜;
(3)检验稀硫酸的存在,只需检验氢离子的存在.
(4)硫酸根离子能与钡离子结合产生不溶于酸的硫酸钡沉淀;
解答 解:(1)铜跟浓硫酸反应的化学方程式注意加热条件,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(2)随着反应进行,浓硫酸不断消耗,浓度逐渐减小,变为稀硫酸,稀硫酸不具有强的氧化性,不能氧化铜,所以铜片未完全溶解,则瓶中可能还有一定量的硫酸剩余
;
故答案为:浓硫酸随反应进行浓度变稀后不与铜发生反应;
(3)稀硫酸是强电解质硫酸的稀溶液,电离出氢离子和硫酸根离子,所以为证明反应结束后的烧瓶中确有余酸,需检验氢离子,
A.用铁粉检验氢离子的存在,铁和氢离子反应生成氢气能检验,故A正确;
B.BaCl2溶液和硫酸根离子反应生成沉淀,无酸剩余时,溶液中存在硫酸根离子,无法证明氢离子存在,不能检验,故B错误;
C.金属银活泼性在氢之后,不能够与稀硫酸反应,不能检验,故C错误;
D.Na2CO3溶液电离出的碳酸根离子和氢离子反应生成二氧化碳和水,所以能检验,故D正确;
故答案为:AD;
(4)硫酸根离子能与钡离子结合产生不溶于酸的硫酸钡沉淀,所以取剩余溶液少许放入试管中,向试管中滴加氯化钡溶液,若产生白色沉淀说明溶液中含有硫酸根离子,否则溶液不含硫酸根离子;
故答案为:取剩余溶液少许放入试管中,向试管中滴加氯化钡溶液,若产生白色沉淀说明溶液中含有硫酸根离子,否则溶液不含硫酸根离子;
点评 本题考查了浓硫酸与铜的反应,掌握浓硫酸的特性是解答的关键,注意氢离子与硫酸根离子检验方法,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NaAl(SO4)2溶液中滴加Ba(OH)2直至SO42-沉淀完全:2Al3++6OH-+3SO42-+3Ba2+=2Al(OH)3↓+3BaSO4↓ | |
| B. | NH4HS溶液与少量的NaOH溶液反应:NH4++OH-=NH3•H2O | |
| C. | 稀H2SO4和Na2S2O3溶液共热:S2O32-+2H+$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+S↓+H2O | |
| D. | 过量Cl2通入Fel2溶液中:3Cl2+2I-+4Fe2+=4Cl-+I2+4Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | a | b | c |
| 合金质量(g) | 0.51 | 0.765 | 0.918 |
| 气体体积(mL) | 560 | 672 | 672 |
 (3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.
(3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 压强不再发生变化 | |
| B. | 平衡时A2、B2、AB的浓度之比是1:1:2 | |
| C. | 单位时间内生成nmol A2的同时生成nmol B2 | |
| D. | 单位时间内有n个A-A断裂的同时有2n 个A-B断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把氯气通入到氯化亚铁溶液中 | B. | 把绿豆大的钾投入无水乙醇中 | ||
| C. | 把碘化钾溶液滴入淀粉溶液中 | D. | 把乙烯通入溴水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 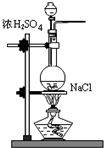 | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、MnO4-、NO3- | B. | K+、Na+、Cl-、NO3- | ||
| C. | NH4+、AlO2-、Na+、CH3COO- | D. | Fe3+、S2-、Al3+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未将烧杯和玻璃棒的洗涤液移入容量瓶 | |
| B. | 溶解搅拌时液体飞溅 | |
| C. | 用量筒量取浓盐酸时,仰视读数 | |
| D. | 定容时水加多了,用滴管吸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com