
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.请回答钢铁在腐蚀、防护过程中的有关问题.
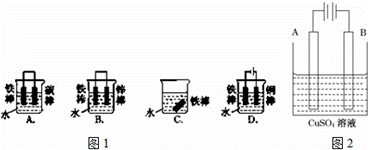
(1)图1哪个装置可防止铁棒被腐蚀BD.
(2)在实际生产中,可在铁 件的表面镀铜防止铁被腐蚀.装置示意图如图2. 请回答
件的表面镀铜防止铁被腐蚀.装置示意图如图2. 请回答
①A电极对应的金属是铜(写元素名称),B电极的电极反应式是 .
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 .
考点: 原电池和电解池的工作原理;金属的电化学腐蚀与防护.
专题: 电化学专题.
分析: (1)铁为活泼金属,易发生电化学腐蚀,当为原电池负极时,易发生电化学腐蚀,如铁为原电池的正极或外接电源的负极,可防止腐蚀;
(2)电镀时,镀层金属为阳极,镀件金属为阴极,形成原电池反应时,铁为负极,铜为正极.
解答: 解:(1)A.形成原电池反应,铁为负极,碳为正极,为铁的吸氧腐蚀,故A错误;
B.锌比铁活泼,铁为正极,被保护而难以腐蚀,故B正确;
C.水中溶解氧气,铁可发生腐蚀,故C错误;
D.铁连接电源负极,为阴极,被保护不易腐蚀,故D正确.
故答案为:BD;
(2)①在铁件的表面镀铜,铜为阳极,铁为阴极,B发生还原反应,电极方程式为Cu2++2e﹣=Cu,
故答案为:铜;Cu2++2e﹣=Cu;
②铁比铜活泼,形成原电池反应时,铁为负极,铜为正极,镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,而锌比铁活泼,形成原电池反应时,铁为正极,锌为负极,铁难以被氧化,
故答案为:镀层破损后, 镀铜铁形成的原电池中铁作负极被腐蚀,镀锌铁形成的原电池中铁为正极被保护.
镀铜铁形成的原电池中铁作负极被腐蚀,镀锌铁形成的原电池中铁为正极被保护.
点评: 本题考查原电池知识,侧重于金属的腐蚀与防护的考查,为高频考点,注意把握原电池的工作原理以及金属的防护方法,难度不大.


科目:高中化学 来源: 题型:
下列关于化学反应速率的说法正确的是()
A. 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加
B. 化学反应速率为“0.8mol/(L•s)”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L
C. 根据化学反应速率的大小可以知道化学反应进行的快慢
D. 对于任何化学反应来说,反应速率越大,反应现象越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是()
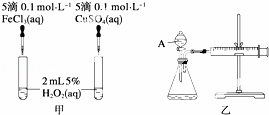
A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知 X2、Y2、Z的起始浓度分别为 0.1mol/L,0.3mol/L,0.2mol/L,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是()
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D. Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置中发生反应的离子方程式为:Zn+2H+═Zn2++H2↑,下列说法错误的是()

A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜﹣锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应符合如图p﹣υ变化曲线的是()

A. H2(g)+I2(g)⇌2HI(g) B. 3NO2(g)+H2O(l)⇌2HNO3(l)+NO(g)
C. 4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g) D. CO2(g)+C(s)⇌2CO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列热化学方程式分析,C(s)的燃烧热△H等于()
C(s)+H2O(l)=CO(g)+H2(g);△H1=+175.3kJ•mol﹣1
2CO(g)+O2(g)=CO2(g);△H2=﹣566.0kJ•mol﹣1
2H2(g)+O2(g)=2H2O(l);△H3=﹣571.6kJ•mol﹣1.
A. △H1+△H2﹣△H3 B. 2△H1+△H2+△H3
C. △H1+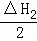 +△H3 D. △H1+
+△H3 D. △H1+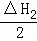 +
+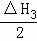
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不正确的是 ( )。
A.加热法只可软化暂时硬度的硬水
B.海水淡化的主要方法有蒸馏法和电渗析法等
C.反应2NaR+Ca2+===CaR2+2Na+的逆反应在一定条件下也能发生
D.硬水软化就是除净水中的Ca2+和Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. CaCl2在熔融状态下可导电,它是强电解质
B. 没有单质参加的化合反应一定是非氧化还原反应
C. 元素处于最高价态时一定具有强氧化性
D. 在2KClO3+4HCl(浓)═2KCl+2ClO2+Cl2+2H2O中,氯气既是氧化产物又是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com