


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
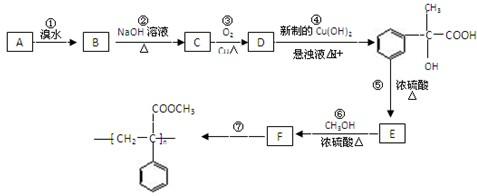
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料 |
| B、石油分馏得到的汽油、煤油、柴油等都有固定的熔沸点 |
| C、石油炼制的目的是为了获得轻质油和重要化工原料(乙烯、丙烯等) |
| D、电解冶炼铝的原料是氯化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
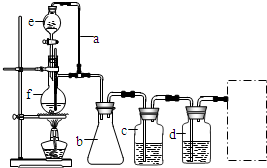 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH=CH2+CO+H2
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH=CH2+CO+H2 | 一定条件 |
| H2 |
| Ni△ |
| 浓硫酸 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g) | 74 | 0.0009 | 0.02 |
| A、已知MgCO3的Ksp=6.8×10-6(mol?L-1)2,则所有含固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.8×10-6 (mol?L-1)2 |
| B、将MgCl2与水混合,再对溶液蒸干、灼烧,最终所得固体产物为MgO |
| C、除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
| D、用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
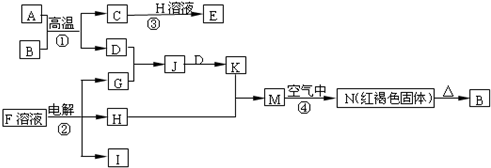
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c( HC2O4-) |
| B、NaHSO4 溶液:c(H+)=c(SO42-)+c(OH-) |
| C、Na2S溶液:c(Na+ )>c(HS-)>c(OH-)>c(H2S) |
| D、pH=2的盐酸与pH=12的氨水等体积混合,c(Cl-)>c(H+)>c(NH4+ )>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ⅰ、Ⅱ途径分别达到平衡时,两体系内相同气体的浓度相等 |
| B、Ⅰ、Ⅱ途径分别达到平衡时,两体系内相同气体的体积分数相等 |
| C、Ⅰ、Ⅱ途径分别达到平衡时,两体系内相同气体的反应速率相等 |
| D、Ⅰ、Ⅱ途径分别达到平衡时,Ⅱ的气体密度是Ⅰ的两倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com