
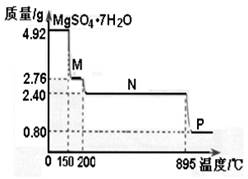
 MgO+SO3↑
MgO+SO3↑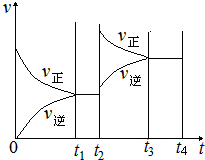
 MgSO4?(7-x)H2O+xH2O
MgSO4?(7-x)H2O+xH2O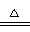 MgSO4?(7-Y)H2O+YH2O
MgSO4?(7-Y)H2O+YH2O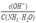 MgO+SO3↑。
MgO+SO3↑。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源:不详 题型:单选题
 Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近| A.1.0 | B.2.0 | C.3.0 | D.4.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
 2CO(g)+2H2(g) 的△H= ;
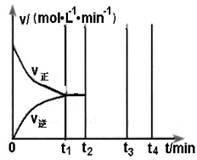
2CO(g)+2H2(g) 的△H= ;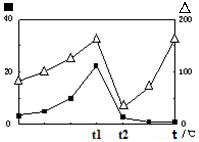 (?代表CO的生成速率,■代表催化剂的催化效率)
(?代表CO的生成速率,■代表催化剂的催化效率)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是| A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大 |
| B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态 |
| C.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍 |
| D.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
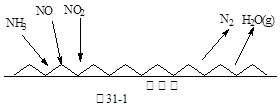
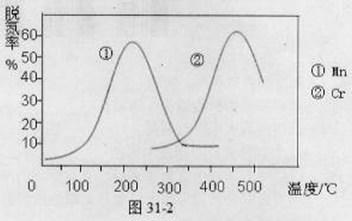
 H2SO3(l)
H2SO3(l) H+(aq)+HSO3—(aq) I
H+(aq)+HSO3—(aq) I H+(aq)+SO32—(aq) II
H+(aq)+SO32—(aq) II Ca2+(aq)+2OH—(aq) III
Ca2+(aq)+2OH—(aq) III CaSO3(s) IV
CaSO3(s) IV查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是 | A.减少NO2的浓度 | B.降低温度 | C.增加NO2的浓度 | D.升高温度 |
 N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )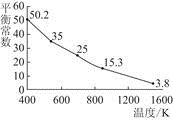
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com