
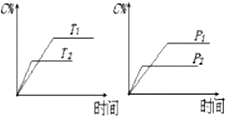
| A. | 达平衡后,加入催化剂则C%增大 | B. | 达平衡后,若升温,平衡左移 | ||
| C. | 化学方程式中n>c+d | D. | 达平衡后,增加A的量平衡向右移动 |
分析 左图中,根据“先拐先平数值大”知,T1<T2,升高温度,C的含量减小,说明平衡逆向移动,则正反应是放热反应;
右图中,根据“先拐先平数值大”知,P1<P2,增大压强,C的含量减小,平衡逆向移动,则n<c+d;
据此分析解答.
解答 解:左图中,根据“先拐先平数值大”知,T1<T2,升高温度,C的含量减小,说明平衡逆向移动,则正反应是放热反应;
右图中,根据“先拐先平数值大”知,P1<P2,增大压强,C的含量减小,平衡逆向移动,则n<c+d;
A.催化剂只改变化学反应速率,不影响平衡移动,所以加入催化剂C%不变,故A错误;
B.该反应的正反应是放热反应,升高温度,平衡逆向移动,故B正确;
C.根据以上分析知,n<c+d,故C错误;
D.A为固体,A的量多少不影响平衡移动,所以增加A的量平衡不移动,故D错误;
故选B.
点评 本题考查化学平衡移动影响因素,为高频考点,侧重考查学生识图能力,明确温度、压强对平衡移动影响原理是解本题关键,利用“先拐先平数值大”确定温度或压强相对大小,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 1.5mol/L | D. | 3.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 | |
| B. | 实验室制硝基苯时,将硝酸与苯混合后再滴加浓硫酸 | |
| C. | 实验时手指不小心沾上苯酚,立即用70℃以上的热水清洗 | |
| D. | 实验室检验卤代烃时,试剂只需用NaOH的水溶液和AgNO3溶液即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与CuSO4溶液反应:2Na+Cu=Cu↓+2Na+ | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3 | |
| B. | 在澄清石灰水中通入过量CO2:OH-+CO2=HCO3- | |
| C. | 在碳酸氢钙溶液中加入过量NaOH溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:14H2O+7O2+28e-=28OH- | |
| B. | 放电一段时间后,负极周围的pH升高 | |
| C. | 放电过程中OH-向正极移动 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素全部都是副族元素 | |
| B. | 短周期共有32 种元素 | |
| C. | 科学研究时,经常在过渡元素中寻找耐高温、耐腐蚀的合金材料 | |
| D. | 元素周期表共七个横行代表七个周期,18 个纵横代表18 个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com