
������һ����ࡢ��Ч��������Դ��
I.�ü�����ȡ�����ķ�Ӧ��Ϊ�������������仯����ͼ��ʾ��
��1�������ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ�� ��
II.���ݻ�Ϊ1L���ܱ������ڣ�����0.1molCO��0.1molH2O���ڴ������ڵ������¸��¼���ʹ�䷴Ӧ�����CO2��Ũ����ʱ��仯��ͼ����ͼ��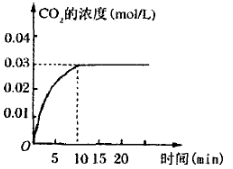
��2���ڸ��¶��£��ӷ�Ӧ��ʼ���ﵽƽ��ʱ��CO��ƽ����Ӧ����Ϊ ��
��3�����¶��£��˷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ�������÷�����ʾ�� ��
��4�����иı��У���ʹƽ��������Ӧ�����ƶ����� ��
| A�������¶� | B������ѹǿ |
| C������H2O��g����Ũ�� | D������CO2��g����Ũ�� |
��ÿ��2�֣���10�֣�
��1��CH4(g) + 2H2O(g) �� 4H2(g) + CO2(g) ��H����136.5 kJ/mol
��2��0.003 mol��L-1��min-1 ��3��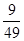 ��4��CD
��4��CD
��5��������Q= ,���Ը÷�Ӧ������Ӧ�������
,���Ը÷�Ӧ������Ӧ�������
���������������1������ͼ���֪�������ˮ����������������������CO2�������������Ը��ݸ�˹���ɿ�֪���÷�Ӧ�ķ�Ӧ���Ǧ�H��-103.3 kJ/mol��33.2 kJ/mol����136.5 kJ/mol��������ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ��CH4(g) + 2H2O(g) �� 4H2(g) + CO2(g) ��H����136.5 kJ/mol��
��2������ͼ���֪����Ӧ���е�10minʱ�õ�ƽ��״̬��ƽ��ʱ����CO2��Ũ����0.03mol/L��������CO��Ũ����0.03mol/L������CO�ķ�Ӧ������0.03mol/L��10s��0.003 mol��L-1��min-1��
��3��ƽ��ʱCO��ˮ������Ũ�Ⱦ���0.1mol/L��0.03mol/L��0.07mol/L����������CO2��������Ũ�Ⱦ���0.03mol/L�����Ը��¶��·�Ӧ��ƽ�ⳣ��K�� ��
��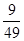 ��
��
��4��A������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���A����ȷ��B����Ӧǰ��������䣬��������ƽ�ⲻ�ƶ���B����ȷ��C������ˮ������Ũ�ȣ�ƽ��������Ӧ�����ƶ���C��ȷ��D����СCO2��Ũ�ȣ�ƽ��������Ӧ�����ƶ���D��ȷ����ѡCD��
��5������ʼʱc(CO)��1mol��L-1 , c(H2O)��2 mol��L-1����Ӧ����һ��ʱ����H2��Ũ��Ϊ0.4 mol��L-1����˵������CO��ˮ������Ũ�Ⱦ���0.4mol/L������ƽ��ʱCO��H ˮ������Ũ�ȷֱ���0.6mol/L��1.6mol/L����Q�� �����Ը÷�Ӧ������Ӧ������С�
�����Ը÷�Ӧ������Ӧ������С�
���㣺���鷴Ӧ�ȡ���Ӧ���ʡ�ƽ�ⳣ���ļ��㡢���������ƽ��״̬��Ӱ���Լ�ƽ�ⳣ����Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����֪���ױȰ����ȶ�����֪��4P(���ף�s��+5O2��g����2P2O5��s�� ��H1��
4P�����ף�s��+5O2��g����2P2O5��s�� ��H2����H1�ͦ�H2�Ĺ�ϵ�ǡ�H1 ��H2���������������
��������
��2����֪H2��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ��mol-1��-726.5kJ��mol-1��д����CO2
��H2����Һ̬�״���Һ̬ˮ���Ȼ�ѧ����ʽ ��
��3����֪һ���¶��£����з�Ӧ��ƽ�ⳣ����SO2(g)+1/2O2(g)  SO3(g) K1,CO(g)+1/2O2(g)
SO3(g) K1,CO(g)+1/2O2(g)  CO2(g) K2������ͬ�¶��·�ӦSO2(g)+CO2(g)
CO2(g) K2������ͬ�¶��·�ӦSO2(g)+CO2(g)  SO3(g)+CO(g)��ƽ�ⳣ��Ϊ ��
SO3(g)+CO(g)��ƽ�ⳣ��Ϊ ��
����K1��K2��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����֪2H2��g��+O2��g��=2H2O��l����H����571.6 kJ/mol��
CO��g����1/2O2��g����CO2��g����H����283.0 kJ/mol��ijH2��CO�Ļ��������ȫȼ��ʱ�ų�113.74 kJ������ͬʱ����3.6 gҺ̬ˮ����ԭ���������H2��CO�����ʵ���֮��Ϊ___________��
��2���Լ״�������������������ҺΪԭ�ϣ�ʯīΪ�缫���ɹ���ȼ�ϵ�أ���֪��ȼ�ϵ�ص��ܷ�Ӧʽ�ǣ�2CH3OH +3O2+4OH-=2CO32-+6H2O����ȼ�ϵ�ط�����Ӧʱ����������Һ��PH__________ (����� ����С�� ���䡱)�õ�صĸ�����ӦʽΪ_________________��
��3�� ������ȼ�ϵ�ؽ��д�ͭ�ľ�������ͭӦ���ӵ�Դ��________�����ô�ͭ�������ص�������ӦʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
I����ͼ��ʾ4��̼ԭ�����ϵķ�ʽ��С���ʾ̼ԭ�ӣ�С����ʾ��ѧ��������̼ԭ��������Ļ�ѧ�����������ϡ�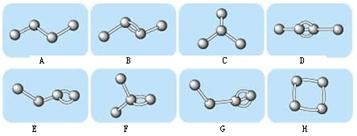
��1��ͼ�������������� �����ţ�������ϩ������ �����ţ���
��2����ͼ����B��Ϊͬ���칹�嵫������ͬ��������ʵ��ǣ� �������ţ�
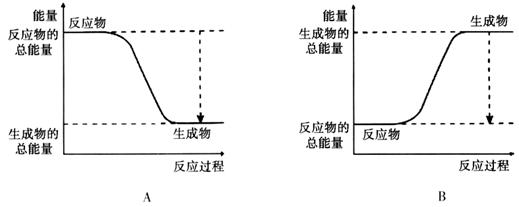
II���α�������?���֡���Ŀ������һ�����ݣ��ƻ�1mol�����еĻ�ѧ����Ҫ����436kJ�������ƻ�1/2mol�����еĻ�ѧ����Ҫ����249kJ���������γ�ˮ������1 mol H��O���ܹ��ͷ�463kJ������
��ͼ��ʾ������������Ӧ�����������ı仯���뽫ͼ�Т١��ڡ��۵������仯����ֵ�������±ߵĺ����ϡ�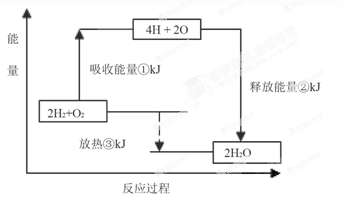
�� kJ���� kJ���� kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
CO��NO��NO2��SO2�ȶ�����Ⱦ�������к����壬������л��������ǽ��ܼ��ŵ���Ҫ���⡣
��1��������������ֱ����������л������������ ��
��2��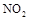 ��������
��������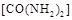 ��ԭ��������CԪ�صĻ��ϼ�Ϊ+4�ۣ�����Ӧ�ķ���ʽΪ��
��ԭ��������CԪ�صĻ��ϼ�Ϊ+4�ۣ�����Ӧ�ķ���ʽΪ��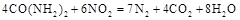 �������ĵ�12g����ʱ��ת�Ƶ��ӵ����ʵ����� ��
�������ĵ�12g����ʱ��ת�Ƶ��ӵ����ʵ����� ��
��3��SNCR-SCR��һ�����͵�����������������ȥ�����е�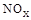 ��,�������з�������Ҫ��Ӧ�У�
��,�������з�������Ҫ��Ӧ�У�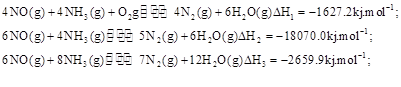
��Ӧ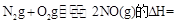 KJ/mol
KJ/mol
��4��CO�����ںϳɼ״�����Ӧ����ʽΪ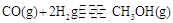 ����һ�ݻ��ɱ���ܱ������г���10mol CO��20molH2���ڴ��������·�����Ӧ���ɼ״���CO��ƽ��ת���ʣ�a�����¶�(T)��ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��
����һ�ݻ��ɱ���ܱ������г���10mol CO��20molH2���ڴ��������·�����Ӧ���ɼ״���CO��ƽ��ת���ʣ�a�����¶�(T)��ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��
��÷�Ӧ��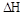 0���>����<���������ﵽƽ��״̬Aʱ�����������Ϊ10L������ƽ��״̬Bʱ���������Ϊ L��
0���>����<���������ﵽƽ��״̬Aʱ�����������Ϊ10L������ƽ��״̬Bʱ���������Ϊ L��
��5����ҵ���ð�ˮ����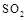 ת���ɶ�(NH4)2SO3����������(NH4)2SO4��(NH4)2SO4��Һ������Ũ�ȴ�С˳��Ϊ ����֪25��ʱ��0.05mol/L(NH4)2SO4��Һ��
ת���ɶ�(NH4)2SO3����������(NH4)2SO4��(NH4)2SO4��Һ������Ũ�ȴ�С˳��Ϊ ����֪25��ʱ��0.05mol/L(NH4)2SO4��Һ��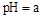 ����
����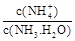 = ���ú�a�Ĵ���ʽ��ʾ����֪
= ���ú�a�Ĵ���ʽ��ʾ����֪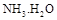 �ĵ��볣��
�ĵ��볣��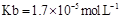 ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ�ϳɰ����Ʊ�����һ��������������������£�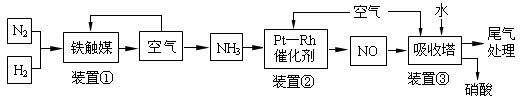
��ش��������⣺
��1��ij����С���о����������������������£��ı���ʼ�����������ʵ������Է�ӦN2(g)��3H2(g) 2NH3(g) ��H����92.4 kJ��mol-1��Ӱ�졣ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����
2NH3(g) ��H����92.4 kJ��mol-1��Ӱ�졣ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����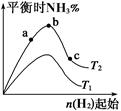
��ͼ����T2��T1�Ĺ�ϵ�ǣ�T2 T1(�>������<������=������ȷ����)��
�ڱȽ���a��b��c����������ƽ��״̬�У�N2��ת������ߵ��� (����ĸ)��
��Ҫʹ��Ӧ�İٷֺ������������ʼ��ϵ��ԭ��Ͷ�ϱ�n(H2)/n(N2) 3���� ��>������<������=������ȷ���������������ݻ���Ϊ1 L����ʼ״̬n(H2)="3" mol����Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%�����������(T2)����Ӧ��ƽ�ⳣ��K= �����������С�������λ��
��2����֪��N2(g)��O2(g) 2NO(g) ��H����180.5 kJ��mol-1
2NO(g) ��H����180.5 kJ��mol-1
2H2(g)��O2(g) 2H2O(g) ��H����483.6 kJ��mol-1
2H2O(g) ��H����483.6 kJ��mol-1
����17 g�����������侭��������ȫ��Ӧ������һ�����������ˮ��������ù��������ų�������Ϊ kJ��
��3����װ�â��У�NH3��O2��145��Ϳ�ʼ���з�Ӧ���ڲ�ͬ�¶Ⱥʹ������������ɲ�ͬ�������ͼ��ʾ����
�¶Ƚϵ�ʱ���� Ϊ�����¶ȸ���900��ʱ��NO�����½��Ŀ���ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��15�֣��������糧�ͷų������������NOx����SO2��CO2���������ɻ������⡣��ȼú���������������������̼�ȴ�������ʵ����ɫ���������ܼ��š��������õ�Ŀ�ġ�
��1�����������ü������ԭNOx��
CH4(g) �� 4NO2(g) ��4NO(g) �� CO2(g) �� 2H2O(g) ��H1����574 kJ��mol��1
CH4(g) �� 4NO(g) ��2N2(g) �� CO2(g) �� 2H2O(g) ��H2����1160 kJ��mol��1
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ ��
��2����̼����CO2ת��Ϊ�״���CO2(g)��3H2(g) CH3OH(g)��H2O(g) ��H3
CH3OH(g)��H2O(g) ��H3

����һ���º����ܱ������г���1 mol CO2��3 mol H2����������Ӧ�����CO2��CH3OH(g)Ũ����ʱ��仯��ͼ1��ʾ���ش�0~10 min�ڣ�������ƽ����Ӧ����Ϊ mol/(L��min)����10 min�����¶Ȳ��䣬����ܱ��������ٳ���1 mol CO2(g)��1 mol H2O(g)����ƽ�� ������������������ƶ���
��ȡ��ݵ������CO2��H2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״�����������գ�CH3OH���뷴Ӧ�¶�T�Ĺ�ϵ������ͼ2��ʾ��������CO2ת��Ϊ�״��ķ�Ӧ�ġ�H3 0�����������������������
��3����������Na2SO3��Һ���ѳ������е�SO2��Na2SO3����NaOH��Һ����SO2�Ƶá�NaOH��Һ����SO2�Ĺ����У�pH��n(SO32-)�Un(HSO3��)�仯��ϵ���±���
| n(SO32��)�Un(HSO3��) | 91�U9 | 1�U1 | 9�U91 |
| pH | 8.2 | 7.2 | 6.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��14�֣��������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ��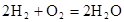 ��
��
��1��Ϊ�˼ӿ�����Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ��________������ţ���ͬ����
| A��ʹ�ô��� | B�����������Ũ�� |
| C����߷�Ӧ���¶� | D�����ͷ�Ӧ���¶� |
| ��ѧ�� | H��H | O��O | H��O |
���� | 436 | 496 | 463 |
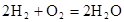 �����У�������________�������������������________��Ӧ�����������ԭ��������·��ÿת��0��2mol���ӣ���״��������H2�������________L��
�����У�������________�������������������________��Ӧ�����������ԭ��������·��ÿת��0��2mol���ӣ���״��������H2�������________L���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO(g)+2H2(g) CH3OH(g) ��H1=��116 kJ��mol��1
CH3OH(g) ��H1=��116 kJ��mol��1
��1�������й�������Ӧ��˵����ȷ����________��
a�����¡����������£������ڵ�ѹǿ�������仯����淴Ӧ�ﵽƽ��
b��һ�������£�H2������������CO���������ʵ�2��ʱ���淴Ӧ�ﵽƽ��
c����������������䣬�����¶ȿ����CO��ת����
d��ʹ�ú��ʵĴ��������̴ﵽƽ���ʱ�䲢���CH3OH�IJ���
��2�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250�桢270�������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1mol����COƽ��ת���ʵĹ�ϵ��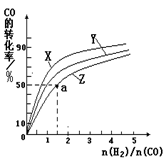
�������������¶��У�����Z��Ӧ���¶��� ��
������ͼ��a���Ӧ�����ݣ�����÷�Ӧ�ڶ�Ӧ�¶��µ�ƽ�ⳣ��K ��д��������̣���
���ڴ����Ӧλ���ϻ�����������Ӧ�ﵽƽ���С��ϵѹǿ���ﵽ�µ�ƽ������У����淴Ӧ������ʱ��ı仯��ϵͼ����ע��
��3����֪��CO(g)+ O2(g)=CO2(g) ��H2=��283 kJ��mol��1
O2(g)=CO2(g) ��H2=��283 kJ��mol��1
H2(g)+ O2(g)=H2O(g) ��H3=��242 kJ��mol��1
O2(g)=H2O(g) ��H3=��242 kJ��mol��1
���ʾ1mol��̬�״���ȫȼ������CO 2��ˮ����ʱ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com