
(1)设NA代表阿伏加德罗常数,某晶体的化学式为Na0.35CoO2·1.3H2O,已知1 mol该晶体的质量是122.45g,则该晶体的相对分子质量是__________;钴原子与氧原子的物质的量之比是________(比值可以用小数表示);1 mol该晶体中含有的氧原子数目为______________
(2)在相同条件下,体积均相等的 CH4、N2、CO2、O2四种气体中,含有原子数目最多的是 ,质量最大的是________________
(3)将27.8gFeSO4·7H2O溶于水配成100mL FeSO4溶液,从中取出20mL,此20mL溶液中C(Fe2+)为 ,m(FeSO4) 为 ,将取出的20mL溶液加水稀释到100mL,则稀释后溶液中C(FeSO4)为________
(4)完全中和相同体积、相同物质的量浓度的Ba(OH)2溶液,需要相同物质的量浓度的盐酸、硫酸溶液的体积比为 。
(5)在体积为V L的密闭容器中通入x mol CO和y mol O2,在一定条件下反应后,测得此时容器中的C和O的个数之比为__________。
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源:2015-2016学年广西省钦南区高一上学期期中质量调研化学试卷(解析版) 题型:实验题
实验室要用Na2CO3·10H2O晶体配制500 mL 0.1 mol·L-1 Na2CO3溶液,回答下列问题:
(1)应该用托盘天平称取Na2CO3·10H2O____________g。
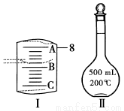
(2)如图Ⅰ表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为8,量筒中液体的体积是____________mL。
(3)若实验中如图Ⅱ所示的仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.定容前容量瓶底部有水珠______________________________________;
B.定容时加水超过刻度线________________________________________;
C.最终定容时俯视观察液面 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上学期期中(理)化学试卷(解析版) 题型:选择题
工业制硫酸中的反应:2SO2+O2 2SO3,等量的反应物在两个容器中反应,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若平衡时甲容器中SO2的百分含量p%,则平衡时乙容器中SO2的百分含量
2SO3,等量的反应物在两个容器中反应,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若平衡时甲容器中SO2的百分含量p%,则平衡时乙容器中SO2的百分含量
A.等于p% B.大于p% C.小于p% D.无法判断
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上学期期中选修化学试卷(解析版) 题型:实验题
实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |

完成下列问题:
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_ 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_____________。大烧杯如不盖硬纸板,求得的中和热数值将 (填“偏大”、“偏小”或“无影响”)。结合日常生活实际该实验在 中(家用产品)效果更好。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH=___ [盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将___ _(填“偏大”、“偏小”、“不变”)。如改用60 mL0.5 mol/L的盐酸与50 mL 0.55 mol·L-1 的NaOH 溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是 。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上学期期中测试化学试卷(解析版) 题型:选择题
不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是
A.分别加热这两种固体物质,并将生成的气体通入澄清的石灰水中
B.分别在这两种物质的溶液中加入CaCl2溶液
C.分别在这两种固体中加入同浓度的稀盐酸
D.分别在这两种物质的溶液中加入少量澄清的石灰水
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上学期10月月考化学试卷(解析版) 题型:实验题
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L氢氧化钠溶液在上图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
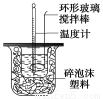
(1)环形玻璃搅拌棒的作用是 。
(2)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热____________(填“偏大”“偏小”或“不变”)。
(3)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 30.6 | 5.5 |
3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容C=4.18×10-3 kJ/(g·℃),则该反应的中和热为ΔH=___________________。
(4)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会_______________(填“偏大”“偏小”或“不变”),其原因是___________。
(5)在中和热测定实验中测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热数值_______________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上学期10月月考化学试卷(解析版) 题型:计算题
(1)100ml 0.2mol/L Na2SO4溶液中含有SO42﹣ mol,Na+的物质的量浓度是 mol/L.
(2)5molCO2的质量是 g;在标准状况下所占的体积约为 L;所含氧原子的数目为 个.
(3)3.01×1023个OH﹣的物质的量为 mol,质量为 g,含有电子的物质的量为 mol,这些OH﹣与 mol NH3的质量相同.
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期期中测试化学试卷(解析版) 题型:实验题
下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 气体发生装置 |
① | 制备氧气 | H2O2→O2 | |
② | 制备氨气 | NH4Cl→NH3 | |
③ | 制备氯气 | HCl→Cl2 |
(1) 从上述气体制备原理中:从制备过程看,必须选择合适的氧化剂才能实现的是 (填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是 。
(2) 根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。

Ⅰ Ⅱ Ⅲ Ⅳ
(3) 某学习小组设计了如下图实验,将氯气依次通过下列装置以验证氯气的性质:
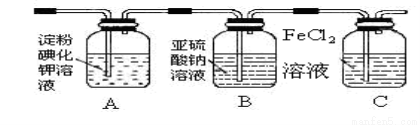
①通入氯气后,A中的现象是 ,整套实验装置存在的明显缺陷是 。
②C装置中发生反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016河北石家庄第一中学高二上期中考试化学试卷(解析版) 题型:选择题
近年来科学家利用合成的方法制备了多种具有特殊结构的有机物,例如具有下列立体结构的环状化合物(其中碳、氢原子均已略去):

有人认为上述有机物中,①立方烷,棱晶烷、金刚烷可以看作是烷烃的同系物;②盆烯是单烯烃;③棱晶烷、盆烯是苯的同分异构体;④金刚烷是癸炔的同分异构体。以上叙述正确的是
A.③ B.①和③ C.②和④ D.除①外都正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com