
| A. | 石灰石溶解在稀HCl中 CO32-+2H+═CO2↑+H2O | |
| B. | 铁屑在稀H2SO4作用下产生H2 Fe+2H+═Fe2++H2↑ | |
| C. | 金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2↑ | |
| D. | 硫酸铜溶液与氢氧化钡溶液混合 Cu2++2OH-═Cu(OH)2↓ |
分析 A.碳酸钙我难溶物,离子方程式中碳酸钙不能拆开;
B.铁与稀硫酸反应生成硫酸亚铁和氢气;
C.2mol铝完全反应生成3mol氢气,该反应不满足电子守恒、电荷守恒;
D.漏掉了钡离子与硫酸根离子生成硫酸钡的反应.
解答 解:A.石灰石的主要成分为碳酸钙,碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.铁屑在稀H2SO4作用下产生H2,该反应的离子方程式为:Fe+2H+═Fe2++H2↑,故B正确;
C.金属铝溶于氢氧化钠溶液,反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故C错误;
D.硫酸铜与氢氧化钡反应生成硫酸钡和氢氧化铜沉淀,正确的离子方程式为:SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓,故D错误;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等


科目:高中化学 来源: 题型:选择题
| A. | 用可见光束可以鉴别红褐色的氢氧化铁胶体和溴水,是因为溶液与胶体的本质区别是能否发生丁达尔效应 | |
| B. | 分散系是一种物质分散到另一种物质中形成的混合体系 | |
| C. | 氢氧化铁胶体具有吸附性,能吸附水中悬浮颗粒并沉降,因而常用于净水 | |
| D. | 淀粉溶液和蛋白质溶液是溶液,不可能是胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝插入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ | |
| C. | 向NaAlO2溶液中通入过量CO2 制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- | |
| D. | 用氨水吸收足量的SO2气体:2OH-+SO2=SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
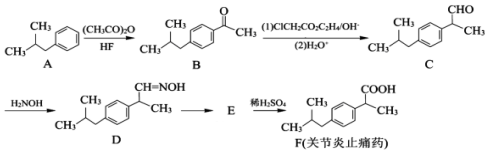
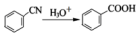 ;②
;②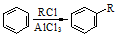 ; ③
; ③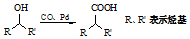 .
.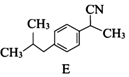 .
.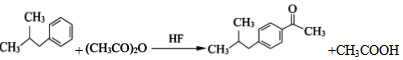 .
.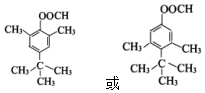 (写一种).
(写一种).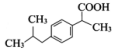 )的一种改良法是以2-甲基-1-丙醇(
)的一种改良法是以2-甲基-1-丙醇(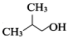 )、苯、
)、苯、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
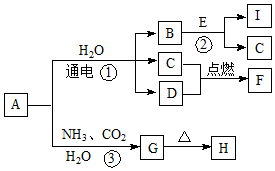
 .
. 
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:实验题
某学生欲配制6.0mol/L的H2SO4溶液1000mL,实验室有三种不同浓度的硫酸:①480mL0.5mol/L的硫酸;②150mL25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为 mol/L (保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为 mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部注入烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸 mL,注入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D. ;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响? (填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意 。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700oC时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。同学们对此有以下“理解”,你认为其中错误的是
A.该反应可能在空气中进行 B.制造过程中元素种类没有改变
C.另一种化合物是NaCl D.这个反应是置换反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
人体正常血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化为Fe3+而中毒,服用维生素C可以解毒。对上述事实的分析正确的是
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被氧化
D.亚硝酸盐被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com