
【题目】Mg—AgCl电池是一种以海水为电解质溶液的水激活电池,电池总反应为Mg+2AgCl===MgCl2+2Ag。下列有关该电池说法错误的是( )
A. 镁为负极 B. AgCl发生了还原反应
C. 电池工作时电能转化为化学能 D. 可用于海上应急照明供电
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是 ( )
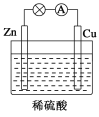

A.①②③
B.②④
C.②④⑥
D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随着能量变化是化学反应的基本特征之一。某同学进行如下实验,以检验化学反应中的能量变化。
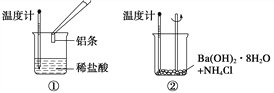
请回答下列问题:
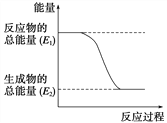
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是________热反应,Ba(OH)2·8H2O与NH4Cl的反应是________热反应。反应过程________(填“①”或“②”)的能量变化可用下图表示。
(2)①中发生反应的离子方程式是____________________________;在该反应中,作为还原剂的物质是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮和含硫化合物的性质在工业生产和环境保护中有重要意义。
(1)制备硫酸可以有如下两种途径:
2SO2(g)+O2(g)=2SO3(g) △H=-198kJ·mol-1
SO2(g)+NO2(g)=SO3(g)+NO(g) △H=-41.8kJ·mol-1
若CO的燃烧热为283 kJ·mol-1,则1molNO2和1mol CO 反应生成CO2和NO的能量变化示意图中E2= _________kJ·mol-1

(2)锅炉烟道气含CO、SO2,可通过如下反应回收硫:2CO(g)+SO2(g)![]() S(I)+2CO2(g)。某温度下在2L恒容密闭容器中通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2。其他条件不变时SO2的平衡转化率反应温度的变化如图A,请解释其原因:_________
S(I)+2CO2(g)。某温度下在2L恒容密闭容器中通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2。其他条件不变时SO2的平衡转化率反应温度的变化如图A,请解释其原因:_________
②第8分钟时,保持其他条件不变,将容器体积迅速压缩至1L,在10分钟时达到平衡,CO的物质的量变化了1mol。请在图B中画出SO2浓度从6~11分钟的变化曲线。

(3)己知某温度下,H2SO3的电离常数为K1≈l.5×10-2, K2≈1.0×10-7,用NaOH溶液吸收SO2,当溶液中HSO3-, SO32-离子相等时,溶液的pH值约为_________
(4)连二亚硫酸钠(Na2S2O4)具有强还原性,废水处理时可在弱酸性条件下加入亚硫酸氢钠电解产生连二亚硫酸根,进而将废水中的HNO2还原成无害气体排放,连二亚硫酸根氧化为原料循环电解。产生连二亚硫酸根的电极反应式为_________,连二亚硫酸根与HNO2反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q、W、R、T是元素周期表短期中最常见的主族元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 其某一种同位素,被用作相对原子质量的标准 |
Y | 其最高价氧化物对应水化物能与其气态氢化物发生化合反应 |
P | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 存在质量数为25、中子数为13的核素 |
W | 位于周期表第13列 |
R | 与Z同族, 且最高价氧化物对应水化物的浓溶液常温下与W 单质会出现钝化现象 |
(1)W元素位于周期表第________周期______族;T离子的结构示意图为____________。
(2)将Q、Z、R的简单离子的半径从大到小排序___________(用离子符号表示);R、T两种元素的最高价氧化物对应水化物的酸(或碱)性由强到弱的顺序为__________(用化学式表示)。
(3) X、Y、Z三种元素的简单氢化物中,稳定性最强的化合物的电子式为_________,化合物P2R溶液在空气中长期放置,会和氧气反应生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为______________。
(4)根据下表中的信息,判断下列化合物固态时的晶体类型(填“离子晶体”……等)。
化合物 | x3Y4 | R2T2 |
主要物理性质 | 硬度可以和金刚石相媲美,熔点>3600℃ | 常温下是一种橙黄色液体,熔点为-76°C |
晶体类型 | ________ | _________ |
(5)Q的单质能与X、Z形成的某种化合物反应,写出其化学方程式:______________。
(6)X与Q形成的lmol化合物Q2X3与水反应,生成2molMg(OH)2和1mol某气态烃,该烃分子中碳氢质量比为9: 1,写出该气态烃的结构简式_______,并写出Q2X3与水反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】、完全沉淀相同体积的NaCl、MgCl2、AlCl3溶液中的Cl﹣,消耗等物质的量的AgNO3,则原NaCl、MgCl2、AlCl3溶液的物质的量浓度之比为( )
A.1:2:3 B.3:2:1 C.9:3:1 D.6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是
A.用激光笔照射煮沸过的FeCl3溶液可观察到明亮光路
B.大雾天气用汽车远光灯照射前方常出现明亮光路
C.明矾可用作净水剂
D.臭氧、Cl2均可用于水的消毒净化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
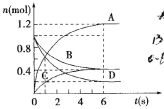
A.该反应的化学方程式为3B+4D=6A+2C
B.反应进行到6s时υ(B)=υ(C)
C.反应进行到6s时,用B表示的平均反应速率为0.05mol·L-1·s-1
D.反应进行到6s时,反应停止了
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com