
在100 mL FeI2溶液中缓缓通入标准状况下的氯气3.36 L,反应完全后,溶液中有一半的Fe2+被氧化生成Fe3+,则原来FeI2溶液的物质的量浓度为:( )
A.l.0 mol?L─1 B.1.2 mol?L─1 C.1.5 mol?L─1 D.0.6 mol?L─1
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
在由Fe、FeO和Fe2O3组成的混合物中加入100 mL 2 mol·L-1的盐酸,恰好使混合物完全溶解,并放出448 mL气体(标准状况),此时溶液中无Fe3+存在。则下列判断正确的是
( )
A.混合物中三种物质反应所消耗的盐酸的物质的量之比为1∶1∶3
B.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.反应后所得溶液中的Fe2+与Cl-的物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应)。
①反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当________时(填实验现象),说明“铁与水蒸气”能够进行反应。
②写出铁与水蒸气反应的化学方程式_______________。
③实验中石棉绒的作用是 。
(2)为了研究一定时间内铁粉的转化率,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成气体的体积,计算出铁粉的转化率。
①收集并测量气体体积应选图中的________装置。
②称取0.24 g铁粉与适量石棉绒混合,然后加热至无气体放出。若室温下氢气密度约为0.088 g/L,最好选用______规格的量筒(选填字母序号)。
A.100 mL B.200 mL
C.500 mL D.1 000 mL
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第9讲 金属及其化合物练习卷(解析版) 题型:实验题
化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下方法来制备这种材料并测定这种材料的组成:
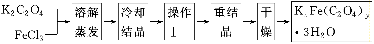
(1)结晶时应将溶液用冰水冷却置于在黑暗处等待晶体的析出,这样操作的原因是:________________________________________________________________________。
(2)操作Ⅰ的名称是______________________。
(3)称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.100 0 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00 mL时恰好完全反应,H2C2O4与酸性KMnO4溶液反应的化学方程式是:__________________________。再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定。当Fe2+完全氧化时,用去KMnO4溶液4.00 mL,此滴定反应的离子方程式是____________。
(4)配制100 mL 0.100 0 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有________(填仪器名称)。滴定终点时溶液颜色为________色,且30秒内不变色。
(5)经计算,化合物KxFe(C2O4)y·3H2O中,x=________。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com