
【题目】现有前四周期原子序数依次递增的五种元素A、B、C、D、E。 A、D元素基态原子中成对电子数是未成对电子数的3倍,且D元素基态原子中有6个未成对电子;B的基态原子核外只有7个原子轨道填充了电子,B、C元素基态原子的3p能级上均有1个未成对电子;E元素排在周期表的15列。
(1)B元素基态原子核外电子有_______种运动状态,电子占据的最高能层符号为_______,该能层具有的原子轨道数为_______、电子数为_____。
(2)C、E两元素可以形成化合物EC3,此化合物的VSEPR模型为_______,是_______分子(填“极性”、“非极性”)。
(3)写出D基态原子的外围电子排布图____________。
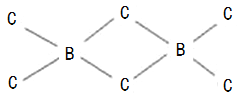
(4)B、C两元素也可以形成共价化合物BC3,但BC3经常以二聚(B2C6)的形式存在,二聚分子具有配位键,分子中原子间成键的关系如下图所示.请将图中,你认为是配位键的斜线上加上箭头。
【答案】(1)13;M;9;3
(2)四面体形;极性
(3)![]()
(4)![]() 或者
或者![]()
【解析】试题分析:(1)B元素是13号铝,基态原子核外电子有 13种运动状态,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为3,故答案为:13;M;9;3;
(2)氯、砷两元素可以形成化合物AsCl3,As是sp3杂化,所以化合物的VSEPR模型为四面体形,是极性分子,故答案为:四面体形;极性;
(3)铬基态原子的外围电子排布图为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)C原子最外层有4个电子,只能与B原子各提供1个电子形成一个共价键,使自己达到8电子稳定结构,而B原子最外层有3个电子,可分别与3个C原子形成共价键,因而C原子与2个B原子形成的化学键中,必有1个是配位键,由于电子对由C原子提供,这样C原子最外层电子数仍为8,B原子最外层也成为8电子结构,如图所示:![]() 或者
或者![]() ,故答案为:
,故答案为:![]() 或者
或者![]() 。
。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N为短周期的第五种主族元素。其中X、Z同主族,Y、Z同周期,M与X、Y既不同主族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)X元素位于元素周期表的位置是第 周期,第 族
(2)请写出下列反应的离子方程式:N单质与氢氧化钠溶液反应:
(3)Y与Z相比,非金属性较强的元素的原子结构示意图为 ,可以证明该结论的实验是(用离子方程式表示) 。
(4)请将X、Z、M、N元素原子半径从大到小排序: (用元素符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(Lmin),下列判断不正确的是( )
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(Lmin),下列判断不正确的是( )
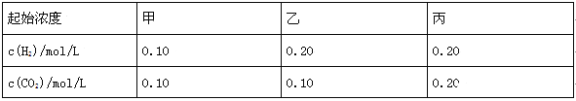
A.平衡时,乙中CO2的转化率大于50%
B.当反应平衡时,丙中c(CO2)是甲中的2倍
C.温度升至800℃,上述反应平衡常数为![]() ,则正反应为吸热反应
,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与原容器乙达平衡时c (CO)不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体。氰化氢的沸点只有26摄氏度,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题
(1)写出氰化钠遇水产生氰化氢的离子方程式
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体碳酸氢钠,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式 。
(3)氰化钠遇到亚硝酸钠能生成氧化钠和两种无污染的气体发生爆炸,写出化学反应方程式 。
(4)爆炸残留在废水中的CN- 可以用Cr2O72-处理,拟定下列流程进行废水处理,
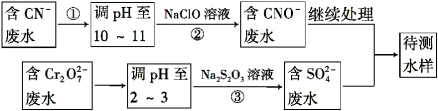
① 上述处理废水流程中主要使用的方法是 ;
A.混凝法 B.中和法 C.沉淀法 D.氧化还原法
② 步骤②反应无气体放出,该反应的离子方程式为_______________________;
③ 步骤③中,每处理0.4 mol Cr2O72 - 时转移电子2.4 mol,该反应的离子方程式为 ___________;
④处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FexⅢCr(2-x)Ⅲ]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol Cr2O72-,需加入amol FeSO4·7H2O,下列结论正确的是 。
A.x=0.5,a=6 B.x=0.5,a=10 C.x=1.5,a=6 D.x=1.5,a=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉和氧化铁粉末的混合物制成的铝热剂可用于焊接钢轨。现取三份不同质量的该铝热剂分别和100mL同浓度的NaOH溶液反应,所取铝热剂的质量与产生气体的体积关系如下表(气体体积均在标准状况下测定)。
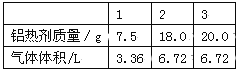
(1)该铝热反应的化学方程式为 。
(2)该铝热剂中加入NaOH溶液时发生反应的化学方程式为 。
(3)求NaOH溶液的物质的量浓度。
(4)求该铝热剂中铝的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)![]() cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是( )
cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是( )

A. 该反应在T1、T3温度时达到化学平衡
B. 该反应在T2温度时达到化学平衡
C. 该反应的逆反应是放热反应
D. 升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)海带中富含碘,请简述检验碘的实验方案_____________________;
(2)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则1molI2(g)分子中化学键断裂时需吸收的能量为_________kJ;
(3)Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
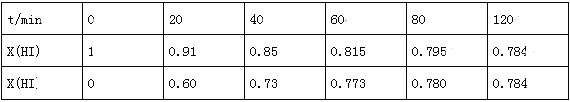
①根据上述实验结果,该反应的平衡常数K的计算式为:______________;(不用求出结果)
②其他条件不变,向平衡后体系中再加入少量HI,则平衡向_______(填“正”或“逆”)反应方向移动,达到平衡后x(HI)_______(填“增大”、“减小”或“不变”)。
③上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为_______(以K和K正表示);若k正=0.0027min-1,在t=40min时,v正=________min-1.
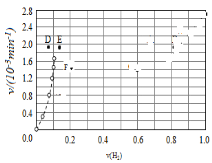
④由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为__________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。
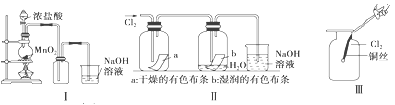
(1)Ⅰ图圆底烧瓶中反应的化学方程式是
(2)Ⅱ图中褪色的是 (填a或b),烧杯中反应的离子方程式是
(3)将Cu丝换成Fe丝,做Ⅲ实验,结果也能点燃,你认为Fe丝也可点燃的最确切的理由是 。
A.Fe与Cu都是金属元素 B.Fe的熔点比Cu高
C.Fe的密度比Cu小 D.Fe的金属性比Cu强
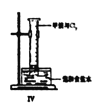
(4)将Ⅳ装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成,量筒内液面上升。油状液滴的成分可能是(写分子式) ,量筒内液面上升的主要原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
(1)在酸式介质中,负极反应的物质为 ,正极反应的物质为 ,酸式电池的电极反应:
负极: ,正极: 。
电解质溶液pH的变化 (填“变大”,“变小”,“不变”)。
(2)在碱式介质中,碱式电池的电极反应:
负极: ,正极: 。
电解质溶液pH的变化 (填“变大”,“变小”,“不变”)。
(3)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是________。
A.太阳光催化分解水制氢气比电解水气氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式相同
(4)纯电动车采用了高效耐用的一种新型可充电电池,该电池的总反应式为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
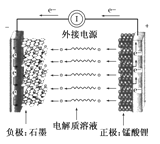
①该电池放电时负极反应式为_________________。
②放电时每转移3 mol电子,正极有________ mol K2FeO4被还原。
锰酸锂离子电池在混合动力车等大型蓄电池应用领域占据主导地位。
电池反应式为:Li1-xMnO4+Lix ![]() LiMnO4,下列有关说法不正确的是________。
LiMnO4,下列有关说法不正确的是________。
A.放电时电池的正极反应式为:Li1-xMnO4+xLi++xe-===LiMnO4
B.放电过程中,石墨没有得失电子
C.该电池也能在KOH溶液的环境中正常工作
D.充电时电池上标有“-”的电极应与外接电源的负极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com