
将1 000 mL 0.1 mol·L-1BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1 000 mL 0.5 mol·L-1HCl溶液与足量CH3COONa溶液充分反应放出b kJ 热量(不考虑醋酸钠水解);将500 mL 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为( )
热量(不考虑醋酸钠水解);将500 mL 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为( )
A.(5a-2b) kJ B.(2b-5a) kJ C.(10a+4b)kJ D.(5a+2b)kJ
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl与KOH+CH3COOH | B. | NaOH+H2SO4与 Ba(OH)2+H2SO4 | ||
| C. | BaCl2+H2SO4与Ba(OH)2+Na2SO4 | D. | CaCO3+H2SO4 与Na2CO3+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:实验题
用中和滴定法测定烧碱的纯度,试根据实验回答:
(1)准确称取4.1g烧碱样品,所用主要仪器是 。
(2)将样品配成250mL待测液,需要的仪器有 。
(3)取10.00mL待测液,用 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时 手旋转酸式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的浓度为: ,样品烧碱的质量分数为________________。(假设烧碱中不含有与酸反应的杂质)
滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(6)滴定过程(酚酞作指示剂),下列情况会使测定结果偏高的是 。
①酸式滴定管用水洗后便装液体进行滴定;②碱式滴定管水洗后,就用来量取待测液;③锥形瓶用蒸馏水洗涤后,又用待测液润洗;④滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下;⑤盐酸在滴定时溅出锥形瓶外;⑥滴加盐酸,溶液颜色褪去但不足半分钟又恢复红色;⑦滴定前,酸式滴定管有气泡,滴定后消失;⑧记录起始体 积时,仰视读数,终点时俯视。
积时,仰视读数,终点时俯视。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
在日常生活中,我们经常看到铁制品生锈、钒制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是 ( )

A.按图I装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图II是图I所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电 极反应:2Cl--2e-=Cl2↑
极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是( )
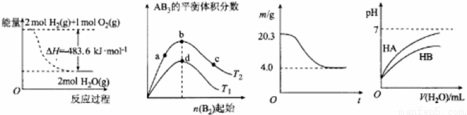
图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A.图Ⅰ表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H =-241.8 kJ·mol-1
B.图Ⅱ表示反应A2 (g)+ 3B2 (g) 2AB3(g),达到平衡时A2的转化率大小为:b>a>c
2AB3(g),达到平衡时A2的转化率大小为:b>a>c
C.图Ⅲ表示0.1mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
D.图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下:
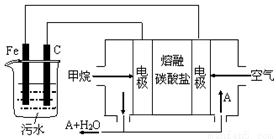
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应分别是
①_____________________________________;
②_____________________________________。
(3)该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①负极的电极反应_______________________.
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是_____________。
(4)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)L。
(5)如图是根据氯碱工业中离子交换膜技术原理设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。
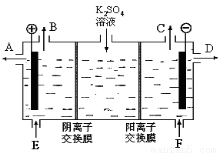
请回答:a为________(填“阳”或“阴”)离子交换膜;从E口流进的物质的化学式(若为溶液,则写出溶质的化学式)为:______________;写出此时电解反应的总化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸
④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
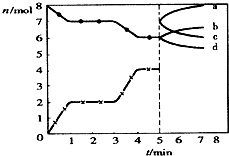
| A. | CO在2-3min和4-5min时平均速率相等 | |
| B. | 当固焦炭的质量不发生变化时,说明反应已达平衡状态 | |
| C. | 5min时再充入一定量的CO,n(CO)、n(CO2)的变化可分别由c、b曲线表示 | |
| D. | 3min时温度由T1升高到T2,重新平衡时K(T2)小于K(T1) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com