
����Ŀ����֪A����̬������ȫȼ��ʱ������CO2��H2O�����ʵ���֮��Ϊ1��1��A����Է�����С��30������ͼ�仯�У��м����C��������һ��Ҳ�ܸ����Ƶ�Cu(OH)2������Ӧ����ש��ɫ������E����ζ��(��Ӧ����δд��)��
![]()
(1)д�����и����仯�Ļ�ѧ����ʽ(ע����Ӧ����)
��Ӧ�� _________________________________��
��Ӧ��__________________________________��
��Ӧ��__________________________________��
��Ӧ��__________________________________��
(2)д�����з�Ӧ���ͣ�
��Ӧ�� _____________________����Ӧ�� _____________________��
��Ӧ�� _____________________����Ӧ�� _____________________��
���𰸡�CH2 = CH2 + H2O![]() CH3CH2OH 2CH3CH2OH + O2
CH3CH2OH 2CH3CH2OH + O2 ![]() 2CH3CHO + 2H2O CH3COOH + C2H5OH
2CH3CHO + 2H2O CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O n CH2 = CH2
CH3COOC2H5 + H2O n CH2 = CH2![]()
![]() �ӳɷ�Ӧ ������Ӧ ������Ӧ �Ӿ۷�Ӧ
�ӳɷ�Ӧ ������Ӧ ������Ӧ �Ӿ۷�Ӧ
��������
A����̬������ȫȼ��ʱ������CO2��H2O�����ʵ���֮��Ϊ1��1������A��C��Hԭ�Ӹ�����Ϊ1��2��A����Է�����С��30������A����ϩ��
�м����C��������һ��Ҳ�ܸ����Ƶ�Cu(OH)2������Ӧ����ש��ɫ������˵��C�к���ȩ��������C����ȩ����B���Ҵ���E����ζ��˵��E�к�������������ʹ���Ӧ������������D�����F�Ǹ߷��ӻ��������F�Ǿ���ϩ���ݴ˷������
(1)��Ӧ��Ϊ��ϩ��ˮ�ڴ��������·����ӳɷ�Ӧ�����Ҵ������Է�Ӧ�ٵķ���ʽΪ��CH2 =CH2+H2O ![]() CH3CH2OH����Ӧ��Ϊ��ͭ���������������������£��Ҵ�����������������ȩ�����Է�Ӧ�ڵķ���ʽΪ��2CH3CH2OH+O2
CH3CH2OH����Ӧ��Ϊ��ͭ���������������������£��Ҵ�����������������ȩ�����Է�Ӧ�ڵķ���ʽΪ��2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O����Ӧ��Ϊ��Ũ���������������������£�������Ҵ�����������Ӧ��������������ˮ����Ӧ����ʽΪ��CH3COOH+C2H5OH
2CH3CHO+2H2O����Ӧ��Ϊ��Ũ���������������������£�������Ҵ�����������Ӧ��������������ˮ����Ӧ����ʽΪ��CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O����Ӧ��Ϊ��һ�������£���ϩ�����Ӿ۷�Ӧ���ɾ���ϩ����Ӧ����ʽΪ��n CH2=CH2
CH3COOC2H5+H2O����Ӧ��Ϊ��һ�������£���ϩ�����Ӿ۷�Ӧ���ɾ���ϩ����Ӧ����ʽΪ��n CH2=CH2 ![]()
![]() ���ʴ�Ϊ��CH2 =CH2+H2O
���ʴ�Ϊ��CH2 =CH2+H2O ![]() CH3CH2OH��2CH3CH2OH+O2
CH3CH2OH��2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O��CH3COOH+C2H5OH
2CH3CHO+2H2O��CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O��n CH2=CH2
CH3COOC2H5+H2O��n CH2=CH2 ![]()
![]() ��
��
(2)��ϩ��ˮ�����Ҵ��ķ�Ӧ�Ǽӳɷ�Ӧ���Ҵ�������ȩ�ķ�Ӧ����������Ӧ��������Ҵ��������������ķ�Ӧ����������Ӧ����ϩ���ɾ���ϩ�ķ�Ӧ���ڼӾ۷�Ӧ���ʴ�Ϊ���ӳɷ�Ӧ��������Ӧ��������Ӧ���Ӿ۷�Ӧ��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ����ͨ�������ַ�����
���ù��������������Ȼ�粒��ȣ�
���ڳ������ù�������������Ũ��ˮ��Ӧ��
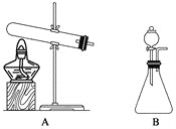
(1)�������ȡװ��ͼ�У�������Ӧѡ��װ��__________(����A������B������ͬ)��������Ӧѡ��װ��__________��
(2)�����Ȼ�����������ƻ������ȡ�����ķ�Ӧ����ʽ��________________��
(3)����ȡ�����Ҫ���ﰱ����Ӧѡ�õĸ������________________������ĸ����
A��Ũ���ᡡ����B����ʯ�ҡ�����C������������
(4)���鼯��ƿ���Ƿ��ռ��������ķ�����__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�ij�ܱ������з�����Ӧ��N2(g)��3H2(g)![]() 2NH3(g)����Ӧ��N2��Ũ����10s�ڴ�2mol/L���1.5mol/L������10s��H2�ķ�Ӧ����Ϊ�� ��
2NH3(g)����Ӧ��N2��Ũ����10s�ڴ�2mol/L���1.5mol/L������10s��H2�ķ�Ӧ����Ϊ�� ��
A. 0.05mol/LB. 0.05mol/��L��s��C. 0.15mol/��L��s��D. 0.2mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������TiO2��Ϳ�ϡ��������ױƷ���������ż���㷺��Ӧ�á��Ʊ�����TiO2�ķ���֮һ��TiCl4ˮ������TiO2xH2O�������ˡ�ˮϴ��ȥ���е�Cl-���ٺ�ɡ����ճ�ȥˮ�ֵõ�����TiO2����������ԭ�ζ����ⶨTiO2������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+������KSCN��Һ��ָʾ������NH4Fe(SO4)2����Һ�ζ�Ti3+��ȫ������Ti4+����ش��������⣺
��1��TiCl4ˮ������TiO2xH2O�Ļ�ѧ����ʽΪ______________________________��
��2������NH4Fe(SO4)2����Һʱ������һ����H2SO4��ԭ����__________��ʹ�õ���������ƽ��ҩ�ס����������ձ�����Ͳ�⣬����Ҫ��ͼ�е�__________������ĸ���ţ���
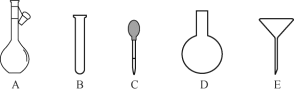
��3���ζ��յ���ж�������________________________________________��
��4���ζ�����ʱ����ȡTiO2��Ħ������ΪM g/mol������wg������c mol/LNH4Fe(SO4)2 ����ҺVmL����TiO2������������ʽΪ______________________________��
��5���ж����в�����TiO2���������ⶨ�����Ӱ�죨�ƫ�ߡ���ƫ�͡�����Ӱ�족����
���������Ʊ���Һ�����У��ձ��е�NH4Fe(SO4)2��Һ������������ʹ�ⶨ���__________��
�����ڵζ��յ��ȡ�ζ��̶ܿ�ʱ�����ӱ�ҺҺ�棬ʹ�ⶨ���__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�ָ�Ч��ɫ�������������ڷ�ˮ��������ˮ�Ĵ������ӻ��������ĽǶȿ����Ʊ��������νϺõķ���Ϊ��ⷨ��Fe+2H2O+2OH![]() FeO42-+3H2��,����ԭ����ͼ��ʾ����֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ������˵����ȷ����
FeO42-+3H2��,����ԭ����ͼ��ʾ����֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ������˵����ȷ����
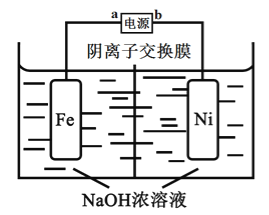
A. b�ǵ�Դ������
B. �����缫��ӦΪFe-6e-+4H2O= FeO42-+ 8H+
C. �������У���Ҫ���������������弰ʱ�ų�
D. ����·��ͨ��1mol���ӵĵ���ʱ������11.2L��H2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100 ��ʱ����N2O4��NO2�ֱ����������Ϊ1 L���ܱ������У�������0.1mol N2O4 ������0.2 mol NO2��������Ӧ��2NO2(g) ![]() N2O4(g)����H��0������˵����ȷ���ǣ� ��
N2O4(g)����H��0������˵����ȷ���ǣ� ��
A. ƽ��ʱ�����з�Ӧ���ת���ʦ�(N2O4) +��(NO2)=1
B. ƽ��������������ͨ��һ������NO2���ִﵽƽ��ʱ��NO2�������������
C. ��ֻ�ı�һ������ʹ������NO2��ƽ��ת����������÷�Ӧ�Ļ�ѧƽ�ⳣ��һ�����
D. ƽ���Ӧ�ų���������������ֵQ��Q(��) ��Q(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ΪV L�ĺ����ܱ�������ʢ��һ����H2��ͨ��Br2(g)������Ӧ��H2(g)��Br2(g)![]() 2HBr(g) ��H��0�����¶ȷֱ�ΪT1��T2��ƽ��ʱ��H2�����������Br2(g)�����ʵ����仯��ϵ����ͼ��ʾ������˵����ȷ����
2HBr(g) ��H��0�����¶ȷֱ�ΪT1��T2��ƽ��ʱ��H2�����������Br2(g)�����ʵ����仯��ϵ����ͼ��ʾ������˵����ȷ����

A. ��ͼ��֪��T1��T2
B. a��b����ķ�Ӧ���ʣ�b��a
C. Ϊ�����Br2(g)��ת���ʣ��ɲ�ȡ��HBrҺ������ʱ���ߵķ���
D. T1ʱ������Br2(g)���룬ƽ��ʱHBr�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȼ��Ϊԭ�Ϻϳɼ״����й��Ȼ�ѧ����ʽ����:
��2CH4(g)+O2(g)=2CO(g)+4H2(g) ��H1=-70.8 kJ��mol-1
��CO(g)+2H2(g)![]() CH3OH(g)�� ��H2
CH3OH(g)�� ��H2
��2CH4(g)+O2(g)![]() 2CH3OH(g) ��H3=-251.0 kJ��mol-1
2CH3OH(g) ��H3=-251.0 kJ��mol-1
(1)��H2=____kJ��mol-1��
��2���ں����ܱ�����������ʵ�����1:1����һ������̼��ˮ������Ӧ����ˮú����һ�������´ﵽƽ�⣬���ı䷴Ӧ��ijһ����ʱ�����б仯��˵��ƽ��һ��������Ӧ�����ƶ�����_________��������ţ�
A.����Ӧ�������������� B.��ѧƽ�ⳣ��K����
C.�ټ���һ����̼ D.��Ӧ�����������������
(3)������ɱ���ܱ�������Ͷ��1 mol CO��2 mol H2,�ڲ�ͬ�����·�����Ӧ:
CO(g)+2H2(g)![]() CH3OH(g)��ʵ����CH3OH�����ʵ������¶ȡ�ѹǿ�ı仯��ͼ��ʾ��
CH3OH(g)��ʵ����CH3OH�����ʵ������¶ȡ�ѹǿ�ı仯��ͼ��ʾ��
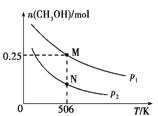
�ٸ÷�Ӧ�Է����е�������_____________������¡��������¡��������¶ȡ���
��506 Kʱ����Ӧƽ��ʱH2��ת����Ϊ___��ѹǿ:p1_____(�>����<����=��) p2��
�۷�Ӧ����:N��v��(CO)____(�>����<����=��)M��v��(CO)��
����ѹǿΪp1����1 L�����ܱ������н���������Ӧ(��ʼͶ�ϲ���),�ڲ�ͬ�¶���������Ӧ��ƽ�ⳣ���Ķ���(lg K)��ͼ��ʾ�����¶�Ϊ506 Kʱ,ƽ�ⳣ��K=____(������λС��),B��C��D��E�ĵ�������ȷ��ʾ�÷�Ӧ��lg K��T�Ĺ�ϵ�ĵ�Ϊ____��
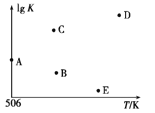
(4)��2 L�����ܱ������г���a(a>0) mol H2��2 mol CO��7.4 mol CH3OH(g),��506 K�½���������Ӧ��Ϊ��ʹ�÷�Ӧ�������,a�ķ�ΧΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaH���������������Ӧ�Ļ�ѧ����ʽΪNaH�� H2O��NaOH�� H2�����÷�Ӧ�У�ˮ��������
A.�ܼ�B.��ԭ��
C.������D.���ǻ�ԭ������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com