
����Ŀ��ijУѧϰС���ͬѧ���ù�ҵ����м(��Ҫ�ɷ�ΪFe,����������FeS��Fe3P��)�Ʊ�FeSO4��7H2O,��̽��FeSO4��7H2O���·ֽ�IJ��
I.�Ʊ�ʵ�鲽������:
�ٳ�ȡһ�����ķ���м�����ȵ�̼������Һ���ݣ���������ˮϴ�ӡ�
�ڽ�������ķ���м������ƿ��,��������3mol/L������,���Ӻ�װ��(��ͼ)��ˮԡ��������Ӧ��ȫ��
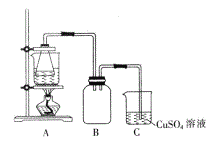
����������ֹͣ���ȣ����ȹ��ˣ�����Һ�в����������ᡣ
�ܽ���Һ��ȴ���ᾧ�����ˡ�ϴ�ӡ�
�ش���������
(1)����ٳ���5.6g����мʱ,����������Ʒ��λ�÷ŷ��ˣ���Ƶõķ���м��������____ (�������С�����䡱)��
(2)���������������������,ʹ���۹���,��Ŀ����_____________��
(3)װ��C��������_____________��
(4)�������ϴ��ʱ���õ�ϴ�Ӽ������_____________��
A.ϡ���� B.��ˮ�Ҵ� C.��
(5)�ⶨ��Ʒ�Ĵ���:
��ȡmg��Ʒ��������ƿ��,�þ���й�����ȴ������ˮ��ϡ�����ܽ�,Ȼ��cmol/L��KMnO4����Һ�ζ�,����VmLKMnO4����Һ��
�ζ������з�����Ӧ�����ӷ���ʽΪ________;��Ʒ�Ĵ���Ϊ_________(�г��������ʽ����)��
��.̽��FeSO4��7H2O���·ֽ�IJ����ʵ��װ�ü��������£������������:
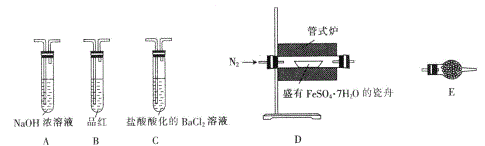
�������� | ʵ������ | ����ԭ�� |
��װ������,�ȳ��뵪�����ټ��ȹ�ʽ¯��700��һ��ʱ�� | �Թ�E�еİ�ɫ������� | �ֽ�õ��IJ����к�ˮ���� |
������ᆳ���Թ�Bʱ | Ʒ����Һ��ɫ | (6)_____________ |
������ᆳ���Թ�Cʱ | �Թ�C�г��ְ�ɫ���� | (7)C�з�Ӧ�Ļ�ѧ����ʽΪ_____________ |
�������з�Ӧ��Ĺ�����������ϡ���ᣬ�ٵ��뼸��KSCN��Һ | (8)_____________ | (9)_____________ |
���𰸡� ��С ��֤��Һ�в���Fe3+ ��ȥH2S,PH3������ B MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O ![]() 100% �ֽ�õ��IJ����к�SO2 BaCl2+H2SO4=BaSO4��+2HCl(��BeCl2+SO3+H2O=BaSO4��+2HClO ��Һ��� �����к���SO2��SԪ�صĻ��ϼ۽���,��FeԪ�ذ��ϼۻ�����,��������ϡ�����,��Һ����Fe3+
100% �ֽ�õ��IJ����к�SO2 BaCl2+H2SO4=BaSO4��+2HCl(��BeCl2+SO3+H2O=BaSO4��+2HClO ��Һ��� �����к���SO2��SԪ�صĻ��ϼ۽���,��FeԪ�ذ��ϼۻ�����,��������ϡ�����,��Һ����Fe3+
��������(1)����ٳ���5.6g����мʱ,����������Ʒ��λ�÷ŷ��ˣ���ȷʱ����������������������������Ʒ���������ŷ�����Ʒ��������������������������������������Ʒ������Ϊ4.4g����Ƶõķ���м���������С��(2)���������������������,ʹ���۹���, ��֤��Һ�в���Fe3+��(3) ��м�л���������FeS��Fe3P�ȣ���ϡ���ᷴӦ����H2S,PH3����Ⱦ�����壬��װ��C�������dz�ȥH2S,PH3�����ʣ�(4) A.ϡ�����������������ӣ�ѡ��A��ѡ��B.��ˮ�Ҵ���ͬʱ����FeSO4��7H2O�����ˮ��ѡ��Bѡ��C.����ˮ�����ܣ����ʺ���Ϊϴ�Ӽ���ѡ��C��ѡ���������ϴ��ʱ���õ�ϴ�Ӽ������ˮ�Ҵ�����ѡB��(5)�ζ�������KMnO4��Fe2+����ΪFe3+��������Ӧ�����ӷ���ʽΪMnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;���ݷ�Ӧ����Ʒ�Ĵ���Ϊ![]() ����. (6)������ᆳ���Թ�Bʱ���ֽ�õ��IJ����к�SO2��Ʒ����Һ��ɫ��(7) ������ᆳ���Թ�Cʱ�����Ȼ�����Ӧ���ְ�ɫ������C�з�Ӧ�Ļ�ѧ����ʽΪBaCl2+H2SO4=BaSO4��+2HCl(��BeCl2+SO3+H2O=BaSO4��+2HClO��(8)�������з�Ӧ��Ĺ�����������ϡ���ᣬ�ٵ��뼸��KSCN��Һ����Һ��죬��Ϊ�����к���SO2��SԪ�صĻ��ϼ۽���,��FeԪ�ذ��ϼۻ�����,��������ϡ�����,��Һ����Fe3+��
����. (6)������ᆳ���Թ�Bʱ���ֽ�õ��IJ����к�SO2��Ʒ����Һ��ɫ��(7) ������ᆳ���Թ�Cʱ�����Ȼ�����Ӧ���ְ�ɫ������C�з�Ӧ�Ļ�ѧ����ʽΪBaCl2+H2SO4=BaSO4��+2HCl(��BeCl2+SO3+H2O=BaSO4��+2HClO��(8)�������з�Ӧ��Ĺ�����������ϡ���ᣬ�ٵ��뼸��KSCN��Һ����Һ��죬��Ϊ�����к���SO2��SԪ�صĻ��ϼ۽���,��FeԪ�ذ��ϼۻ�����,��������ϡ�����,��Һ����Fe3+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���Ӹֹ�ʱ����13755Cs���С�����̽�ˡ�������ġ�137����ָ��ԭ�ӵģ� ��
A.������
B.������
C.������
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���బ������һ�����أ��ɷ�������ֻ�����������ֵĽṹ����:

����˵���������
A. �٢ڢ۷��������е�̼ԭ�Ӳ����ܴ���ͬһƽ����
B. �٢ھ���ʹ���Ը��������Һ��ɫ
C. �ڡ��ܻ�Ϊͬ���칹��
D. �۵�һ�ȴ�����5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ͬ�����£����з�Ӧ���ʱ��ƽ�ⳣ���ֱ��ʾΪ��
��2H2O��g��=O2��g��+2H2��g����H1 K1=x
��Cl2��g��+H2��g��=2HCl��g����H2 K2=y
��2Cl2��g��+2H2O��g��=4HCl��g��+O2��g����H3 K3=x
�����й�ϵ��ȷ���ǣ�������
A.��H3=��H1+2��H2 x=xy2
B.H3=��H1+��H2 z=x+y
C.H3=��H1+2��H2 x=x��y2
D.H3=��H1+��H2 z= ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ������60%��þ�ǴӺ�ˮ����ȡ�ģ���Ҫ�������£�
����˵������ȷ���ǣ� ��
A. Ϊʹ��ˮ�е�MgSO4ת����Mg��OH��2���Լ��ٿ�ѡ��ʯ����
B. �����Լ��ٺ���õ�Mg��OH��2�����ķ����ǹ���
C. �����Լ��ڷ�Ӧ�����ӷ���ʽΪ��OH��+H+=H2O
D. ͨ��������ڵ���ˮMgCl2�õ�48gMg����ת��4mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Al��Ag2O�����һ�ֿ�����ˮ�¶�����������Դ����ԭ����ͼ��ʾ���õ�ع���ʱ�ܷ�ӦʽΪ2Al��3Ag2O��2NaOH=2NaAlO2��6Ag��H2O��������˵��������� (����)��

A. ����ʱ����������ԭ��Ӧ��������������С
B. ���缫������1.08 g Agʱ����·��ת�Ƶĵ���Ϊ0.1 mol
C. Al�缫�ķ�ӦʽΪAl��3e����4OH��=AlO2����2H2O
D. ����ʱ���Һ�е�Na������Ag2O/Ag�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ--���ʽṹ������]��������,����ɲ⡣��������仯�����ʵ������ṹ�����˱仯�Ľ�����ش���������:
(1)�����ӻ���������жϣ����з��ӵĿռ乹����V�ε���____(����)��
A.BeCl2 B.H2O C.HCHO D.CS2
(2)ԭ������С��36��Ԫ��Q��T,�����ڱ��м�λ��ͬһ������λ��ͬ-һ��,��T��ԭ��������Q��2��T�Ļ�̬ԭ�ӵ���Χ����(�۵���)�Ų�ʽΪ_____,Q2+��δ�ɶԵ�������_____.
(3)ͭ����Ͻ�����������ʹ�õĽ�������,Cu2+����NH3�γ���λ��Ϊ4�������[Cu(NH3)4]SO4��
��ͭԪ�������ڱ��е�λ����______, [Cu(NH3)4]SO4��,N��O��S����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ_______��
��[Cu(NH3)4]SO4��,���ڵĻ�ѧ����������_____(����)��
A.���Ӽ� B.������ C.��λ�� D.�Ǽ��Լ� E.���Լ�
��NH3��Nԭ�ӵ��ӻ����������_____,д��һ����SO42-��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ:_____________��
��[Cu(NH3)4]2+���жԳƵĿռ乹��,[Cu(NH3)4]2+�е�����NH3������Cl-ȡ��,�ܵõ����ֲ�ͬ�ṹ�IJ���,��[Cu(NH3)4]2+�Ŀռ乹��Ϊ_____________��
(4)CuO�����ṹ��ͼ��ʾ��

�þ�����ܶ�Ϊ��g/cm3,��þ�����ͭ�����������Ӽ���������Ϊ_____ (�ú��ѵĴ���ʽ��ʾ�����а����ӵ�������NA��ʾ)cm��
(5)��Cu2O�����ṹ��,Cu�������������϶,O����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ͨ������N2��g����H2��g������NH3��g����N2��g��+3H2��g��2NH3��g����H=��92.4kJmol��1
��1����һ���¶��£�����10amolN2��30amolH2����2L���ܱ������У���ַ�Ӧ����ƽ��ʱN2��ת����Ϊ60%����÷�Ӧ��ƽ�ⳣ��Ϊ���ú�a�Ĵ���ʽ��ʾ��������ʱ�����������Ͷ��10amolN2��20amolH2��20amolNH3 �� �ж�ƽ���ƶ��ķ�������������ƶ����������ƶ������ƶ�������
��2������Ӧ��ʼʱN2��H2��NH3��Ũ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.1mol/L����NH3�ﵽƽ��ʱŨ�ȵķ�ΧΪ����ƽ��ʱN2��H2��NH3��Ũ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.1mol/L����NH3��ʼʱŨ�ȵķ�ΧΪ ��
��3��һ�������£����ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й����������
���� | �� | �� | �� | |
��Ӧ��Ͷ���� | 1molN2��3molH2 | 2molNH3 | 4molNH3 | |
ƽ��ʱ���� | ��Ӧ�����仯�ľ���ֵ��kJ�� | Q1 | Q2 | Q3 |
��Ӧ��ת���� | a1 | a2 | a3 | |
��ϵѹǿ��Pa�� | p1 | P2 | P3 | |
��Q1+Q2=kJ��a1+a2l���������������=����ͬ����2p2p3
��4����ͼ��A�Ǻ��ݵ��ܱ�������B��һ������ɱ�ij������ң����ֺ��£��ر�K2 �� ��1molN2��3molH2ͨ��K3����B�У���2molN2��6molH2ͨ��K1����A�У���ʼʱA��B�������ͬ��Ϊ1L���ﵽƽ��ʱ��V��B��=0.9L��Ȼ���K2 �� һ��ʱ���ִﵽƽ��ʱ��B�����ΪL����ͨ��������������ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��ϩͨ���ۺϷ�Ӧ�ɵõ��߷��Ӳ���
B. �۱�ϩ�Ľṹ��Ԫ�ǡ�CH2-CH2-CH2��
C. ̼��ά���ںϳ��л��߷��ӻ�����
D. ����ϩ���ϵ��ϻ�����Ϊ�����˼ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com