
| A. | ③>①>④>② | B. | ①>②>③>④ | C. | ③>②>①>④ | D. | ①>④>③>② |
分析 根据只有和电负性大的元素(如O,N,F等)相连的H与电负性大的元素(如O,N,F等)相连才能形成氢键,元素的电负性越大,形成的氢键越强,电负性:同周期从左到右,元素的电负性逐渐变大.
解答 解:F、O、N三种元素的非金属性依次减弱,所以电负性依次减小,所以F-H,O-H,N-H结合非金属的能力依次减弱,因此氢键的强弱顺序为F>O>N;对与O-H…N,N-H…N的比较,可以从得电子的能力来看,由于O的得电子能力大于N,因此O-H的电子云与N-H的电子云相比,O-H的电子云更偏向O,远离H,因此在O-H…N,N-H…N的氢键中,N-H…N的氢键更弱些,
故选A.
点评 本题考查了氢键强弱的判断,题目难度不大,理解氢键形成的条件是解题的关键,注意抓住元素电负性大小进行比较.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 3.4g NH3 | B. | 0.1mol NH4NO3 | C. | 6g NH4NO3 | D. | 13.2g (NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | X和R在同一周期 | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的稳定性:Y>X | |
| D. | X、Z可形成化学式为Z2X和Z2X2的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
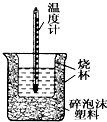 50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
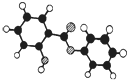 萨罗(Salol)是一种消毒剂,为芳香族化合物,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).则下列说法不正确的是( )
萨罗(Salol)是一种消毒剂,为芳香族化合物,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).则下列说法不正确的是( )| A. | 萨罗的分子式为C13H10O3 | |
| B. | 1mol萨罗与浓溴水反应,需要消耗3mol Br2 | |
| C. | 1mol萨罗发生水解,需要消耗3mol NaOH | |
| D. | 萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )| A. | 正反应吸热,A是气体 | B. | 正反应吸热,A是固体 | ||
| C. | 正反应放热,A是气体 | D. | 正反应放热,A是固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 许多金属和合金具有低温下失去电阻的特性,即具有超导性 | |
| B. | 两个较轻的原子核聚合为一个较重的原子核时要释放出大量的能量,所释放的能量可用于发电 | |
| C. | 天然的、人为的各种电磁波干扰和有害的电磁辐射会造成电磁污染 | |
| D. | 美国科学家利用分子组装技术研制出世界上最小的“纳米算盘”,该算盘的算珠由球形C60分子构成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com