
分析 (1)同温同压下,根据n=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$计算;
(2)根据分子的组成判断气体物质的量的关系,根据n=$\frac{V}{{V}_{m}}$计算;
(3)根据nn=$\frac{V}{{V}_{m}}$计算物质的量,根据m=nM计算质量,根据ρ=$\frac{m}{V}$计算密度.
解答 解:(1)同温同压下,气体的Vm相等,根据n=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$可知:气体的分子数之比等于气体的体积之比,则A容器和B容器的容积之比是1:1,
故答案为:1:1;
(2)若两容器中所含原子总数相等,则根据分子组成可知,两容器中的分子数之比等于3:2,n=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$可知:气体的分子数之比等于气体的体积之比,为3:2,
故答案为:3:2;
(3)若两容器的体积比为3:2,根据n=$\frac{V}{{V}_{m}}$可知O2和O3物质的量之比为3:2;
两个容器中气体质量之比为:3mol×32g/mol:2mol×48g/mol=1:1,根据ρ=$\frac{m}{V}$计算,密度之比=$\frac{1}{3}$:$\frac{1}{2}$=2:3,
故答案为:3:2;2:3.
点评 本题考查阿伏加德罗定律及推论的应用,题目难度不大,注意物质的量的有关计算公式的运用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L已烷含有的共价键总数为19NA | |
| B. | 1mol Cu与足量FeCl3溶液反应,转移的电子数为2NA | |
| C. | 1L 0.1mol•-1 Na2CO3溶液中CO32-和HCO3-离子数之和为0.1NA | |
| D. | 密闭容器中1.5molH2与0.5molN2充分反应,得到NH3的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,NA个H2和O2的混合气体的体积约为22.4 L | |
| B. | 1mol SiO2晶体中,含有2NA个Si-O键 | |
| C. | 0.1 mol Cl2溶解于一定体积的水中,转移电子数为0.2NA | |
| D. | 标准状况下,11.2 L H2O所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、分液、萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1 mol•L-1硫酸中所含的氧原子数为4NA | |
| B. | 标准状况下,11.2LCCl4所含的原子数为2.5NA | |
| C. | 2.3gNa中所含的电子数为1.1NA | |
| D. | 常温常压下,14g由N2与CO组成对混合气体中所含对原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
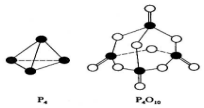 白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )
白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1.根据图示的分子结构和有关数据估算生成1mol P4O10时,反应的能量变化正确的是( )| A. | 吸收(6a+5d-4c-12b)kJ热量 | B. | 放出(4c+12b-6a-5d)kJ热量 | ||
| C. | 吸收(4c+12b-4a-5d)kJ热量 | D. | 放出(4a+5d-4c-12b)kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
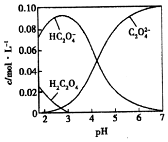 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )| A. | pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | pH=7.0的溶液中:c(Na+)=2(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
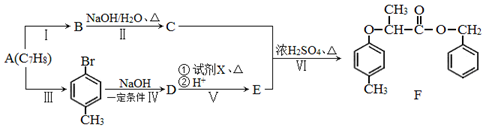
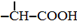 $→_{红磷、△}^{Cl_{2}}$
$→_{红磷、△}^{Cl_{2}}$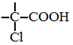
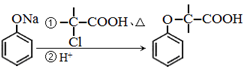
 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaCl.
+NaCl. .
.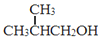 为原料制取
为原料制取 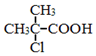 的合成路线图.
的合成路线图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com