
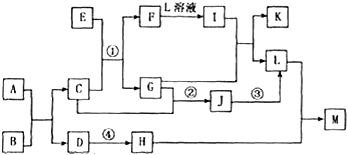
已知反应①、②是化工生产中的两个重要反应
①甲溶液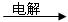 A + B + C
A + B + C
②乙经过粉碎后在沸腾炉中燃烧,得到D和E
其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体。请回答:
(1)A的电子式是 。
(2)将A通入B的溶液中,反应的离子方程式是 。
(3)1 g C在A中燃烧时放出92.3 kJ的热量,该反应的热化学方程式是 。
(4)工业上可利用E为原料冶炼其中所含的金属,方法是 。
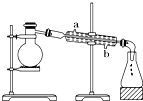
(5)化工生产②中第二步、第三步用到的设备名称分别为 、 。第二步采用的反应条件为 。
(6)将A和D按物质的量1:1通入下列装置中:
该过程中的化学方程式是: _______________________。
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出。
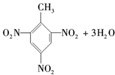
(7)一定条件下,将12 g乙放入过量的的浓硝酸中,反应过程中转移1.5 mol电子,该反应的离子方程式是 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
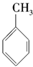 +3HO-NO2
+3HO-NO2
| ||
| △ |

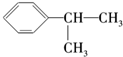

 +O2
+O2| 催化剂 |
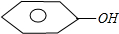 +
+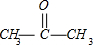
 +O2
+O2| 催化剂 |
 +
+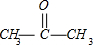
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?上海模拟)三聚氰胺(化学式:C3N6H6)是一种非食品类的重要有机化工原料,广泛用于塑料、造纸、建材等行业.下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺--“常压气相一步法联产纯碱新技术”:
(2012?上海模拟)三聚氰胺(化学式:C3N6H6)是一种非食品类的重要有机化工原料,广泛用于塑料、造纸、建材等行业.下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺--“常压气相一步法联产纯碱新技术”:| 一定条件下 |
查看答案和解析>>
科目:高中化学 来源: 题型:
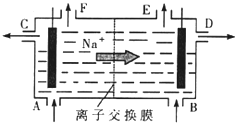 [化学选修2-化学与技术]我国氯碱工业迅速发展,产量已跃居世界首位,并培植了精细化工“产品树”.
[化学选修2-化学与技术]我国氯碱工业迅速发展,产量已跃居世界首位,并培植了精细化工“产品树”.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com