
| A. | ①③⑤ | B. | ③⑤ | C. | ②③④ | D. | ①④⑤ |
分析 ①浓硫酸具有强氧化性,但不能氧化二氧化硫;
②只有浓硫酸才能与铜反应;
③浓硫酸能使蔗糖炭化体现了它的脱水性;
④铁与浓硫酸在加热条件下反应生成二氧化硫,体现浓硫酸的强氧化性,铁与稀硫酸反应生成氢气;
⑤浓硫酸具有强的氧化性,常温下使铁铝发生钝化.
解答 解:①浓硫酸具有强氧化性,二氧化硫具有还原性,但不能氧化二氧化硫,所以能干燥二氧化硫,故错误;
②浓硫酸与铜加热反应后,随着反应进行,浓硫酸浓度降低,变为稀硫酸,不与铜反应,所以铜片有剩余,硫酸不可能反应完全,故错误;
③浓硫酸能使蔗糖中的H、O元素以2:1水的形式脱去,从而使蔗糖碳化,该现象体现浓硫酸的脱水性,故正确;
④铁与浓硫酸在加热条件下反应生成二氧化硫,体现浓硫酸的强氧化性,铁与稀硫酸反应生成氢气,所以既有氢气又有二氧化硫生成,故错误;
⑤浓硫酸具有强的氧化性,常温下使铁铝发生钝化,能使用铁制或铝制容器盛放,故正确;
故选:B.
点评 本题考查了物质的性质,熟悉浓硫酸的强氧化性、脱水性、吸水性是解题关键,题目难度不大,注意钝化属于化学变化.


科目:高中化学 来源: 题型:多选题
| A. | 2H2(气)+O2(气)═2H2O(气)△H1 2H2(气)+O2(气)═2H2O(液)△H2 | |
| B. | S(气)+O2(气)═SO2(气)△H1 S(固)+O2(气)═SO2(气)△H2 | |
| C. | C(固)+$\frac{1}{2}$O2 (气)═CO(气)△H1 C(固)+O2 (气)═CO2(气)△H2 | |
| D. | H2(气)+Cl2(气)═2HCl(气)△H1 $\frac{1}{2}$H2(气)+$\frac{1}{2}$Cl2(气)=HCl(气)△H 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Zn2++2e-═Zn | B. | Zn-2e-═Zn2+ | C. | Cu-2e-═Cu2+ | D. | Cu2++2e-═Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4 | B. | Na2O2 | C. | NH3•H2O | D. | NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取氯气,并用氯气与金属钠反应.装置如图所示,微型烧杯中固体KMnO4与滴入浓盐酸反应的化学方程式是:
实验室制取氯气,并用氯气与金属钠反应.装置如图所示,微型烧杯中固体KMnO4与滴入浓盐酸反应的化学方程式是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
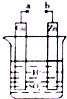
| A. | a和b不连接时,无电流产生,Zn片表面有气泡逸出 | |
| B. | a和b用导线连接,有电流产生,Cu片表面有气泡逸出 | |
| C. | 无论a和b是否连接,Zn片均被腐蚀,溶液的pH均减小 | |
| D. | 若将装置中H2SO4溶液换成CuSO4溶液仍然可以设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质组 | 不属于同类的物质 | 余下的物质属于哪一类物质 |
| (1)MgO、CaO、Na2O、AL2O3 | Al2O3 | 碱性氧化物 |
| (2)CO、CO2、SO2、SiO2 | CO | 酸性氧化物 |
| (3)HClO、H2SO4、HNO3、H3PO4 | H3PO4 | 强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com