
【题目】高铁酸钾(K2FeO4)是一种紫黑色固体,只能在碱性环境中稳定存在,在中性或酸性中易分解,工业中通常是先制得高铁酸钠再转化为高铁酸钾。
I.制备NaCIO溶液
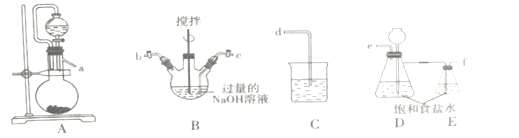
(1)装置的连接顺序为a→___→d。
(2)装置D的作用___。
(3)B装置反应过程中要严格控制温度,温度过高易生成NaClO3,写出生成NaClO3的离子方程式___。
II.制备K2FeO4
(1)湿法制备K2FeO4:将Fe(NO3)3溶液滴加到装置B的混合溶液中,其反应的离子方程式是___。继续向反应后的溶液中加入KOH,会析出紫黑色固体,上述转化能发生的原因是___(用简要的文字说明)。
(2)电解法制备K2FeO4(如图):

该装置中离子交换膜为___离子交换膜(填“阴”或“阳"),阳极电极反应式为___。
III.K2FeO4性质的探究
取电解后的溶液滴加稀盐酸,收集到黄绿色气体。针对以上现象,甲乙两位同学提出了以下猜想:
甲:气体只含有Cl2。
乙:气体除Cl2外还含有___,请设计实验证明乙同学的猜测___。
【答案】efcb 储存氯气 3Cl2 + 6OH- ![]() 5Cl- + ClO3-+ 3H2O 2Fe3+ + 3ClO3-+ 10OH-=2FeO42 +3Cl- + 5H2O 相同条件下,K2FeO4的溶解度比Na2FeO4的溶解度小 阴 Fe6e- + 8OH-=FeO42 + 4H2O O2 将所得的气体通入盛有过量的NaOH溶液的洗气瓶中,收集气体用带火星木条检测,若木条复燃,则乙猜测正确
5Cl- + ClO3-+ 3H2O 2Fe3+ + 3ClO3-+ 10OH-=2FeO42 +3Cl- + 5H2O 相同条件下,K2FeO4的溶解度比Na2FeO4的溶解度小 阴 Fe6e- + 8OH-=FeO42 + 4H2O O2 将所得的气体通入盛有过量的NaOH溶液的洗气瓶中,收集气体用带火星木条检测,若木条复燃,则乙猜测正确
【解析】
A装置实验室制氯气,B装置是氯气与NaOH溶液反应生成NaClO溶液,C装置尾气处理,D装置储存氯气,E装置处理HCl气体,B装置在常温下反应生成NaClO溶液,在温度较高条件下生成NaClO3,NaClO3与Fe(NO3)3在碱性条件下反应生成Na2FeO4,Na2FeO4与KOH根据溶解度的大小发生反应生成K2FeO4,利用铁电解在碱性条件下反应得到FeO42,高铁酸钾在中性或酸性中易分解。据此解答。
I.(1)A装置制氯气,先用E装置饱和食盐水除HCl,再用氯气和氢氧化钠反应B装置制取NaClO,再用C装置处理尾气,因此装置的连接顺序为a→e→f→c→b→d;故答案为:efcb。
(2)装置D的作用储存氯气;故答案为:储存氯气。
(3)B装置反应过程中要严格控制温度,温度过高易生成NaClO3,氯气和氢氧化钠加热反应生成NaCl、水和NaClO3,生成NaClO3的离子方程式 3Cl2 + 6OH- ![]() 5Cl- + ClO3-+ 3H2O;故答案为:3Cl2 + 6OH-
5Cl- + ClO3-+ 3H2O;故答案为:3Cl2 + 6OH- ![]() 5Cl- + ClO3-+ 3H2O。
5Cl- + ClO3-+ 3H2O。
II.(1)将Fe(NO3)3溶液滴加到装置B的混合溶液中,反应生成FeO42、Cl-和H2O,其反应的离子方程式是2Fe3+ + 3ClO3-+ 10OH-=2FeO42 +3Cl- + 5H2O。继续向反应后的溶液中加入KOH,会析出紫黑色固体,上述转化能发生的原因是相同条件下,K2FeO4的溶解度比Na2FeO4的溶解度小;故答案为:2Fe3+ + 3ClO3-+ 10OH-=2FeO42 +3Cl- + 5H2O;K2FeO4的溶解度比Na2FeO4的溶解度小。
(2)该装置中铁作阳极电解变为FeO42,Fe 6e- + 8OH- = FeO42 + 4H2O,阴极是2H2O + 2e-= 2OH-+ H2↑,电解池中OH-向左不断移动,因此离子交换膜为阴离子交换膜;故答案为:阴;Fe 6e- + 8OH- = FeO42 + 4H2O。
III.根据题意高铁酸钾在酸性或中性溶液中发生分解反应会产生氧气,加入盐酸除生成氯气外,还可能生成氧气,可将所得的气体通入过量的NaOH溶液的洗气瓶中,收集气体用带火星木条检测,若木条复燃,则乙猜测正确;故答案为:O2;将所得的气体通入过量的NaOH溶液的洗气瓶中,收集气体用带火星木条检测,若木条复燃,则乙猜测正确。


科目:高中化学 来源: 题型:
【题目】次氯酸及其盐溶液有杀菌、消毒、漂白的作用。在此次抗击新冠疫情中发挥了巨大作用。某学习小组根据需要欲制备浓度不小于0.8mol·L-1的次氯酸溶液。
(查阅资料)
资料1:常温常压下,Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水,且会与水反应生成次氯酸。
资料2:Cl2O的沸点为3.8℃,42℃以上会分解生成Cl2和O2;Cl2的沸点为-34.6℃
该小组用Cl2与潮湿的碳酸钠制取Cl2O,并进一步制取次氯酸,装置如下。
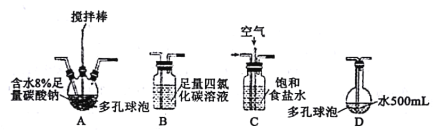
回答下列问题:
(1)装置连接顺序为Cl2→___。(用字母表示)
(2)装置A中反应的化学方程式是___。
(3)装置B的作用___,整个实验加快反应速率所采用的方法有___。
(4)装置D中反应的化学方程式是___。
(5)如果要收集Cl2O,则可以在B装置后连接E装置进行收集,这样做的依据是什么___,逸出气体的主要成分是___。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是___(答出一条即可)。
(7)测定反应完成后A中物质的质量分数:取mg样品加适量蒸馏水使之溶解,加入几滴酚酞,用0.1molL-1的盐酸标准溶液滴定至溶液由红色变为无色,消耗盐酸V1mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸V2mL。
①则由上述实验可测定反应完成后A中物质的质量分数为___(说明具体物质并用含m、V1和V2的代数式表示)。
②若用甲基橙作指示剂滴定结束时,滴定管尖嘴有气泡,对测定结果的影响是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置制取有机物,下列说法错误的是( )

A.根据温度计读数的不同,可制取乙烯和乙醚
B.b为恒压滴液漏斗,其优点是便于液体顺利滴下
C.将产生的气体通入酸性高锰酸钾溶液,若溶液褪色,则证明有乙烯生成
D.浓硫酸在反应中的作用可能有:催化、吸水、氧化、脱水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度(t℃)下,向1 L密闭容器中通入H2和 I2各0.15 mol,发生如下反应: H2(g) + I2(g) ![]() 2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:
2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:
t/min | 2 | 4 | 7 | 9 |
n(I2)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
请回答:
(1)反应到第___________分钟达到平衡状态。
(2)2 min内,v(H2) =______________mol/(L·min)。
(3)下列能证明该反应已经达到平衡的是________(填字母)。
a. v正(H2)= v逆 (HI) b. 混合气体的颜色不再发生变化
c. 混合气体中各组分的物质的量不再发生变化 d. 混合气体的密度不再变化。
(4)①该反应的化学平衡常数表达式为_______________。②H2的平衡转化率是__________________。
(5)升高温度,化学平衡常数K要___________(填“变大”或“变小”)。
(6)该温度(t℃)下,若开始通入一定量的H2和 I2,反应达到平衡时,测得c(H2)=0.4mol/L,c(I2)=0.9mol/L,则平衡时c(HI)=______________mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知两种同素异形体A、B的热化学方程式为:A(s)+O2(g)═CO2(g)△H=﹣393.51 kJ·mol-1;B(s)+O2(g)═CO2(g)△H=﹣395.41 kJ·mol-1则两种同素异形体中较稳定的是(填“A”或“B”)______。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示。
2NH3的能量变化如图所示。
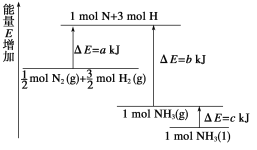
①1 mol N和3 mol H生成1 mol NH3(g)是_______能量的过程(填“吸收”或“释放”)。由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)___________ kJ能量。(用图中字母表示,②同)
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)___________ kJ能量。(用图中字母表示,②同)
②![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)反应生成1 mol NH3(l)的△H = _______________。
mol H2(g)反应生成1 mol NH3(l)的△H = _______________。
(3)工业上用H2和Cl2反应制HCl,各键能为:H﹣H:436 kJ·mol-1,Cl﹣Cl:243 kJ·mol-1,H﹣Cl:431 kJ·mol-1。该反应的热化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O![]() H++OH–;△H>0,下列叙述正确的是
H++OH–;△H>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量稀硫酸,c(H+)增大,Kw不变
D. 向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH===5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2是氧化剂,NaOH是还原剂
B. 被氧化的Cl原子和被还原的Cl原子的个数之比为5∶1
C. Cl2既是氧化剂又是还原剂
D. 每生成1个氧化产物转移6个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是______________。
(2)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S。只由离子键构成的物质是_________;只由极性共价键构成的物质是_____;由极性键和非极性键构成的物质是_______;由离子键和极性键构成的物质是_______。(填序号)。
(3)写出下列物质的电子式:CaF2:______________CO2:______________ NH4Cl:________________。
(4) 用电子式表示下列化合物的形成过程:H2S:__________________________________;MgCl2:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com