
A.当它形成①时,不可能形成④
B.当它形成②时,可以形成③、④
C.当它形成①时,不可能形成②、③
D.当它形成②时,可以形成①
科目:高中化学 来源: 题型:
 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2009~2010学年度第一学期末武汉市部分学校高中二年级调研测试 化学试卷(理科A类) 武汉市教育科学研究院? 题型:022
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)若甲的化学式为RCI3,其溶液在加热蒸干并灼烧时可发生下列反应:
a.甲+H2O![]() 乙+丙
乙+丙
b.乙![]() 氧化物+H2O
氧化物+H2O
①甲为某短周期金属元素R的氯化物,则甲发生a反应的化学方程式为:________
②将以上金属单质与镁用导线连接,插入NaOH溶液中构成原电池,则负极发生的电极反应式为________
(2)若甲、乙、丙均为短周期中同一周期元素形成的单质或化合物,常温下乙为黑色固体单质,甲和丙均为气态化合物,且可发生反应甲+乙![]() 丙,则:
丙,则:
①甲的结构式为________
②写出在200 mL 2 mol/L的.NaOH溶液中通入6.72 L(标准状况下)的气体甲发生完全反应的总离子方程式:________
查看答案和解析>>
科目:高中化学 来源:2014届北京市海淀区高三上学期期中考试化学试卷(解析版) 题型:填空题
X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2, Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为 ;元素Z的离子结构示意图为 。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为 。
(3)元素W位于周期表的第 族, 其非金属性比元素R弱,用原子结构的知识解释原
因 。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂
与足量该氧化物反应的离子方程式 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在
高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:推断题
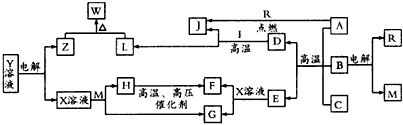
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com