
【题目】下列自发反应可用焓判据来解释的是( )
A. 氢氧化钡和氯化铵的反应
B. 2N2O5(g)![]() 4NO2(g)+O2(g) H=+56.7 kJ/mol
4NO2(g)+O2(g) H=+56.7 kJ/mol
C. (NH4)2CO3(s)![]() NH4HCO3(s)+NH3(g) H=+74.9 kJ/mol
NH4HCO3(s)+NH3(g) H=+74.9 kJ/mol
D. 2H2(g)+O2(g)![]() H2O(l) H=-285.8 kJ/mol
H2O(l) H=-285.8 kJ/mol
【答案】D
【解析】反应能否自发进行取决于焓变和熵变的综合判据,当△G=△H-T△S<0时,反应可自发进行;能用△H判据解释的,是△H<0的反应。
A.氢氧化钡和氯化铵的反应是吸热反应,反应能够自发进行是因为其熵值增加,主要是熵判据,故A错误;B.2N2O5(g)═4NO2(g)+O2(g)△H=+56.7 kJ/mol,反应焓变大于0,为吸热反应,该反应的熵值增加,反应能够自发进行是因为其熵值增加,主要是熵判据,故B错误;C.(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9 kJ/mol,反应为吸热反应,该反应的熵值增加,反应能够自发进行是因为其熵值增加,主要是熵判据,故C错误;D.2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol,该反应熵值减小,反应为放热反应,反应能够自发进行是因为其焓变<0,主要是焓判据,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示。下列说法不正确的是( )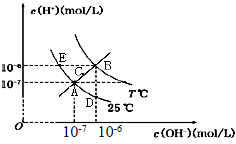
A.图中五点Kw间的关系:B>C>A=D=E
B.E 点对应的水溶液中,可能有NH4+、Ba 2+、Cl-、I-大量同时存在
C.若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A)
D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C都是金属,把A浸入C的硫酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极.A,B,C三种金属的活动性顺序为( )
A.A>B>C
B.A>C>B
C.B>A>C
D.B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,在CO2中通入H2,二者可发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
某实验室控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
反应序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
① | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
② | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
③ | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
④ | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
(1)CO2的电子式是_____________。
(2)反应Ⅰ的平衡常数表达式是K=______。
(3)对比①和③可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因_______________;
对比①、②可发现,在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因____________。
(4)有利于提高CO2转化为CH3OH平衡转化率的措施有____。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.低反应温度
d.投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列给定的溶液中,一定能大量共存的离子组是( )
A.过量Al与NaOH溶液反应所得溶液中:K+、Cl-、Al3+、SO42-
B.常温下,OH-的浓度为10-11mol/L的溶液中:Na+、I-、NH4+、NO3-
C.常温下, ![]() =0.1molL1的溶液中:K+、NH4+、Cl-、SO42-
=0.1molL1的溶液中:K+、NH4+、Cl-、SO42-
D.与Al反应产生H2的溶液中:K+、Na+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) ![]() 2N2+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是 ( )
2N2+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是 ( )
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将BaO2放入密闭真空容器中,反应2BaO2(s) ![]() 2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A. 平衡常数减小 B. BaO量不变 C. 氧气压强不变 D. BaO2量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com