
 .
. .
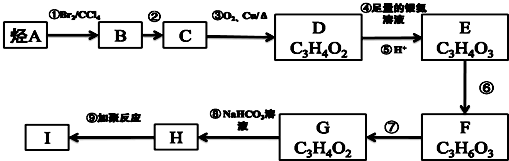
.分析 由转化关系可知,A与溴发生加成反应生成B,B为卤代烃,B水解生成C,C为醇,C氧化生成D,D与银氨溶液反应生成E,由D、E分子式可知,D含有1个-CHO,D的不饱和度为$\frac{2×3+2-4}{2}$=2,故分子中还含有羰基,D的结构简式为 ,故A为CH3CH=CH2,B为CH3CHBrCH2Br,C为CH3CH(OH)CH2(OH),E为CH3COCOOH;由E、F的分子式可知,CH3COCOOH与氢气发生加成反应生成F,F为H3CCH(OH)COOH.由F、G的分子式可知,F发生消去反应生成G,故G的结构简式为CH2=CHCOOH,G与碳酸氢钠反应生成H,H为CH2=CHCOONa,发生加聚反应生成高聚物I,I为
,故A为CH3CH=CH2,B为CH3CHBrCH2Br,C为CH3CH(OH)CH2(OH),E为CH3COCOOH;由E、F的分子式可知,CH3COCOOH与氢气发生加成反应生成F,F为H3CCH(OH)COOH.由F、G的分子式可知,F发生消去反应生成G,故G的结构简式为CH2=CHCOOH,G与碳酸氢钠反应生成H,H为CH2=CHCOONa,发生加聚反应生成高聚物I,I为 ,以此来解答.
,以此来解答.
解答 解:由转化关系可知,A与溴发生加成反应生成B,B为卤代烃,B水解生成C,C为醇,C氧化生成D,D与银氨溶液反应生成E,由D、E分子式可知,D含有1个-CHO,D的不饱和度为$\frac{2×3+2-4}{2}$=2,故分子中还含有羰基,D的结构简式为 ,故A为CH3CH=CH2,B为CH3CHBrCH2Br,C为CH3CH(OH)CH2(OH),E为CH3COCOOH;由E、F的分子式可知,CH3COCOOH与氢气发生加成反应生成F,F为H3CCH(OH)COOH.由F、G的分子式可知,F发生消去反应生成G,故G的结构简式为CH2=CHCOOH,G与碳酸氢钠反应生成H,H为CH2=CHCOONa,发生加聚反应生成高聚物I,I为
,故A为CH3CH=CH2,B为CH3CHBrCH2Br,C为CH3CH(OH)CH2(OH),E为CH3COCOOH;由E、F的分子式可知,CH3COCOOH与氢气发生加成反应生成F,F为H3CCH(OH)COOH.由F、G的分子式可知,F发生消去反应生成G,故G的结构简式为CH2=CHCOOH,G与碳酸氢钠反应生成H,H为CH2=CHCOONa,发生加聚反应生成高聚物I,I为 ,
,
(1)由上述分析可知,A为CH3CH=CH2,I为 ,
,
故答案为:CH3CH=CH2, ;
;
(2)F为H3CCH(OH)COOH,含有羧基、羟基,故答案为:羧基、羟基;
(3)反应⑥是CH3COCOOH与氢气发生加成反应生成H3CCH(OH)COOH,
反应⑦是H3CCH(OH)COOH在浓硫酸加热条件下发生消去反应生成CH2=CHCOOH,
故答案为:加成反应,消去反应;
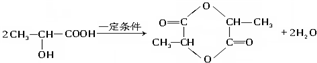
(4)M是一种普遍使用的抗生素类药物,它是由2个H3CCH(OH)COOH分子在一定条件下脱去2个水分子形成的环状酯,该反应的化学方程式为: ,
,
故答案为: ;
;
(5) 有两种能发生银镜反应且属链状化合物的稳定同分异构体,符合条件的同分异构体为:
有两种能发生银镜反应且属链状化合物的稳定同分异构体,符合条件的同分异构体为:
OHCCH2CHO、HCOOCH=CH2,
故答案为:OHCCH2CHO、HCOOCH=CH.
点评 本题考查有机物的推断与合成,注意根据有机物的分子式进行推断,注意掌握官能团的转化,难度中等.


科目:高中化学 来源: 题型:解答题
 ,D在元素周期表中的位置第二周期VIA族.
,D在元素周期表中的位置第二周期VIA族.  .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁片作为负极 | B. | 正极发生氧化反应 | ||
| C. | 电池工作时镁片逐渐被消耗 | D. | 食盐水作为电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯使溴水褪色的原理不同 | |
| B. | 乙烯和聚乙烯中都有碳碳双键 | |
| C. | 煤的气化和液化都是化学变化 | |
| D. | 甲烷中混有乙烯时,仅用酸性KMnO4溶液不能提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
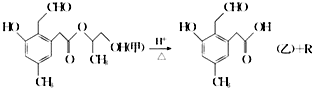
| A. | R为二元醇,不能发生银镜反应 | |
| B. | 1 mol甲在一定条件下与氢气反应,最多可消耗 5mol H2 | |
| C. | 甲在碱性条件下也可发生水解反应 | |
| D. | 甲和乙均能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲正确 | B. | 乙正确 | C. | 甲、乙均正确 | D. | 甲、乙均不正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com