
【题目】微粒M和N,肯定属于同族元素且化学性质相似的是( )
A.结构示意图:M为![]() ,N为
,N为![]()
B.原子核外电子排布式:M为1s22s2,N为1s2
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡。下列说法正确的是( )
CH3OH(g)达到平衡。下列说法正确的是( )
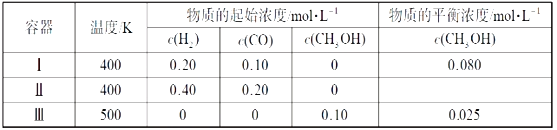
A.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
B.该反应的正反应放热
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
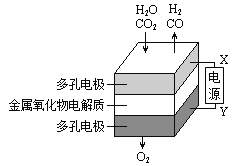
A.阴、阳两极生成的气体的物质的量之比是1︰2
B.X是电源的负极
C.阴极的反应式是:H2O+2e-=H2+O2- CO2+2e-=CO+O2-
D.总反应可表示为:H2O+CO2![]() H2+CO+O2
H2+CO+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能___B元素的第一电离能(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为_________________(用元素符号表示)。
(2)D元素原子的价电子排布式是______________。
(3)C元素的电子排布图为________________________;E3+的离子符号为________。
(4)F元素位于元素周期表的____区,其基态原子的电子排布式为______________。
(5)G元素可能的性质______。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中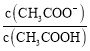 减小
减小
C.醋酸的电离程度增大,c(H+)也增大
D.溶液中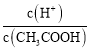 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HF | HCN | H2CO3 |
电离常数 | Ka=3.5×10﹣4 | Ka=5.0×10﹣10 | Ka1=4.3×10﹣7, Ka2=5.6×10﹣11 |
(1)c(H+)相同的三种酸,其酸的浓度从大到小为________________。
(2)0.0lmol/L的HCN溶液中,c(H+)约为_____mol/L。使此溶液中HCN的电离程度增大且c(H+)也增大的方法是_______________________。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a_____b(填“大于”、“小于”或“等于”,下同)b。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1_____n2。
(4)向NaCN中通入少量的CO2,发生的离子方程式为_______________。
(5)设计实验证明氢氟酸比盐酸的酸性弱__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】250C时,向20.0mL0.10mol/L氨水中滴入0.10mol/L盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )
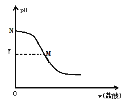
A.本实验应选用的指示剂是甲基橙
B.M点处的溶液中c(NH4+)=c(Cl)>c(H+)=c(OH)
C.N点处的溶液中pH<12
D.M点对应的盐酸体积为20.0mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com