
| A. | 反应4NO2(g)+2NaCl(s)═2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数$\frac{{{k}_{1}}^{2}}{{k}_{2}}$ | |
| B. | 平衡后c(Cl2)=2.5×10-2mol•L-1 | |
| C. | 其他条件保持不变,反应在恒压条件下进行,则平衡常数K2增大 | |
| D. | 平衡时NO2的转化率为50% |
分析 A.①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),平衡常数K1=$\frac{c(ClNO)}{{c}^{2}(N{O}_{2})}$,
②2NO(g)+Cl2(g)?2ClNO(g),平衡常数K2 =$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO)×c(C{l}_{2})}$,
4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=$\frac{{c}^{2}(NO)×c(C{l}_{2})}{{c}^{4}(N{O}_{2})}$,
则[$\frac{c(ClNO)}{{c}^{2}(N{O}_{2})}$]2÷$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO)×c(C{l}_{2})}$=$\frac{{c}^{2}(NO)×c(C{l}_{2})}{{c}^{4}(N{O}_{2})}$;
B.10min时反应达到平衡,测得容器内体系的压强减少20%,则平衡时混合气体总物质的量为(0.2+0.2+0.1)mol×(1-20%)=0.4mol,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.0×10-3mol•L•min-1,则平衡时n(ClNO)=7.0×10-3mol•L•min-1×10min×2L=0.14mol,设①中反应的NO2为xmol,②中反应的Cl2为ymol,则:
2NO2(g)+NaCl(s)═NaNO3(s)+ClNO(g)
xmol 0.5xmol
2NO(g)+Cl2(g)═2ClNO(g)
2ymol ymol 2ymol
再根据ClNO物质的量与平衡时混合气体总物质的量列方程计算解答;
C.平衡常数只受温度影响,温度不变,则为平衡常数不变;
D.根据C中的计算结果,可以计算二氧化氮的转化率.
解答 解:A.①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),平衡常数K1=$\frac{c(ClNO)}{{c}^{2}(N{O}_{2})}$;
②2NO(g)+Cl2(g)?2ClNO(g),平衡常数K2 =$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO)×c(C{l}_{2})}$
4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=$\frac{{c}^{2}(NO)×c(C{l}_{2})}{{c}^{4}(N{O}_{2})}$,
则[$\frac{c(ClNO)}{{c}^{2}(N{O}_{2})}$]2÷$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO)×c(C{l}_{2})}$=$\frac{{c}^{2}(NO)×c(C{l}_{2})}{{c}^{4}(N{O}_{2})}$,即K=$\frac{{{k}_{1}}^{2}}{{k}_{2}}$,故A正确;
B.B.10min时反应达到平衡,测得容器内体系的压强减少20%,则平衡时混合气体总物质的量为(0.2+0.2+0.1)mol×(1-20%)=0.4mol,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.0×10-3mol•L•min-1,则平衡时n(ClNO)=7.0×10-3mol•L•min-1×10min×2L=0.14mol,设①中反应的NO2为xmol,②中反应的Cl2为ymol,则:
2NO2(g)+NaCl(s)═NaNO3(s)+ClNO(g)
xmol 0.5xmol
2NO(g)+Cl2(g)═2ClNO(g)
2ymol ymol 2ymol
则0.5x+2y=0.14,(0.2-x+0.2-2y+0.1-y)+0.5x+2y=0.4,联立方程,解得x=0.12、y=0.04,
故平衡后c(Cl2)=$\frac{0.1mol-0.04mol}{2L}$=3×10-2mol•L-1,故B错误;
C.平衡常数只受温度影响,其他条件保持不变,反应在恒压条件下进行,则平衡常数K2不变,故C错误;
D.平衡时NO2的转化率为$\frac{0.12mol}{0.2mol}$×100%=60%,故D错误,
故选:A.
点评 本题考查了化学平衡的计算、化学平衡常数、影响化学平衡的因素分析应用判断,掌握基础知识是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 硝酸的物质的量浓度为1.2mol/L | |
| B. | 产生的NO在标准状况下的体积为3.36L | |
| C. | Cu与Cu2O 的物质的量之比为1:2 | |
| D. | 反应后剩余HNO3的物质的量为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 | |
| B. | 2mol NO中含2mol氮和2mol O | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 1mol O22-的质量为34g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
| 物质 | 相对分子 质量 | 密度/ (相对于水) | 沸点/℃ | 溶解性 |
| 苯甲醛 | 106 | 1.046 | 178.8 | 微溶于水,可混溶于乙醇、乙醚、苯、氯仿 |
| 苯甲醇 | 108 | 1.042 | 205.7 | 溶于水,易溶于乙醇、醚、芳烃 |
| 苯甲酸 | 122 | 1.271 | 249.2 | 微溶于水,易溶于乙醇、乙醚、氯仿、苯、二硫化碳、四氯化碳 |
| 苯甲酸钠 | 144 | 1.442 | 249.3 | 溶于水和乙醇、甘油、苯、甲醇、微溶于乙醚 |
| 温度/℃ | 25 | 50 | 95 |
| 溶解度/g | 0.17 | 0.95 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2Fe3O4(S)+C.
2Fe3O4(S)+C.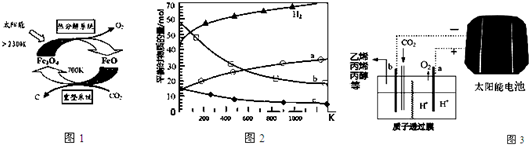
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 将一块Al箔在酒精灯火焰上灼烧 | Al箔熔融而不滴落 | Al与氧气不反应 |
| C | 将一小块Na放入硫酸铜溶液中 | 有铜单质析出 | Na能置换出硫酸铜中的铜 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 DDT又叫滴滴涕,化学名为双对氯苯基三氯乙烷,化学式(ClC6H4)2CH(CCl3).名称从英文缩写DDT而来,为白色晶体,不溶于水,溶于煤油,可制成乳剂,是有效的杀虫剂.DDT进入食物链,是导致一些食肉和食鱼的鸟接近灭绝的主要原因.因此从70年代后滴滴涕逐渐被世界各国明令禁止生产使用.其结构为:下列有关说法正确的是( )
DDT又叫滴滴涕,化学名为双对氯苯基三氯乙烷,化学式(ClC6H4)2CH(CCl3).名称从英文缩写DDT而来,为白色晶体,不溶于水,溶于煤油,可制成乳剂,是有效的杀虫剂.DDT进入食物链,是导致一些食肉和食鱼的鸟接近灭绝的主要原因.因此从70年代后滴滴涕逐渐被世界各国明令禁止生产使用.其结构为:下列有关说法正确的是( )| A. | DDT属于卤代烃类 | |
| B. | DDT完全燃烧后只产生CO2和H2O两种物质 | |
| C. | DDT分子中有一个手性碳 | |
| D. | 氢核磁共振谱图中有5种位置峰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com