
| A. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | B. | Al2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Al+3H2O | ||
| C. | Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2 | D. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |
科目:高中化学 来源: 题型:解答题
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| $\frac{溶解度}{g/100g{H}_{2}O}$ | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮、磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题:
氮、磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题: 是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
是一种天然植物杀虫剂,其中N原子的杂化方式为sp3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 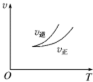 依据图可判断正反应为放热反应 | |
| B. | 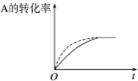 在图中,虚线可表示压缩反应装置体积的情况 | |
| C. | 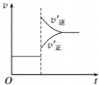 若正反应的△H>0,图可表示升高温度使平衡向逆反应方向移动 | |
| D. | 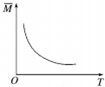 由图中混合气体的平均相对分子质量随温度的变化情况,可推知逆反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纯净水 | B. | 0.1mol•L-1HCl | ||
| C. | 1.0mol•L-1CH3COOH | D. | 0.5mol•L-1H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 2-甲基-2,4-己二烯
2-甲基-2,4-己二烯
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和NaOH完全反应的中和热为-114.6kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g);△H=-283.0kJ/mol | |
| C. | 一个化学反应的热效应,只与反应的始态与终态有关,与反应的过程无关 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管中液面略有上升 | B. | 液面升至试管的$\frac{1}{2}$处 | ||
| C. | 红色液体几乎充满试管 | D. | 无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com