
【题目】常温,下列各组离子在指定溶液中能大量共存的是( )
A. pH=1的溶液中: I-、NO3-、SO42-、Na+
B. 由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C. c(H+)/c(OH-)=1012的溶液中: NH4+、Al3+、NO3-、Cl-
D. c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A. 蒸馏实验时,在烧瓶内加几粒沸石以防止暴沸
B. 制蒸馏水时,应使温度计水银球靠近蒸馆烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 进行过滤时,玻璃棒的末端应轻轻靠在三层的滤纸上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量Cr2O72-和CrO42-,它们会对人类及生态系统产生很大伤害。
已知:i. 2CrO42-(黄色)+ 2H+ ![]() Cr2O72-(橙色)+ H2O
Cr2O72-(橙色)+ H2O
ii. Cr(OH)3(s) + H2O ![]() [Cr(OH)4]- (亮绿色) + H+
[Cr(OH)4]- (亮绿色) + H+
(1) 含铬工业废水的一种处理流程如下:
![]()
① i. 若在转化一步中调节溶液的pH=2,则溶液显_______色。
ii. 能说明转化一步反应达平衡状态的是_______(填字母序号)。
a.Cr2O72-和CrO42-的浓度相同 b.ν正(Cr2O72-) = 2ν逆(CrO42-)
c.溶液的颜色不变 d.溶液的pH不变
② 步骤②还原一步的离子方程式是___________________________;若还原l mol Cr2O72-离子,需要FeSO4·7H2O的物质的量是_______mol。
③ 沉淀一步中,向含Cr3+(紫色)溶液中,逐渐滴加NaOH溶液。当pH=4.6时,开始出现灰绿色沉淀,随着pH的升高,沉淀量增多。当pH≥13时,沉淀逐渐消失,溶液变为亮绿色。
i. 请解释溶液逐渐变为亮绿色的原因:_______。
ii. 若向0.05mol·L-1的Cr2(SO4)3溶液50mL中,一次性加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象是__________。
④ 在K[Cr(OH)4]和K2Cr2O7混合溶液中加入足量H2SO4酸化,铬元素以_______形式存在(填离子符号)。
(2) 用Fe做电极电解含Cr2O72-的酸性工业废水,可以直接除去铬。随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
① 结合上述工业流程分析用Fe做电极的原因:_______。
② 结合电极反应式解释在阴极附近溶液pH升高的原因:_______。
③ 溶液中同时生成的沉淀可能还有_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,A是周期表中原子半径最小的元素,其中B、C同周期,B、D同主族,原子半径E>D>B>C>A。D原子核内质子数等于B、C原子电子数之和,D原子最外层电子数是E原子最外层电子数的4倍。试回答:
(1)B、C、D的最简单氢化物的稳定性由强到弱的顺序是__________(填化学式);
(2)B与C形成的三原子分子甲的结构式是________,C与E形成的原子个数比为1∶1的化合物乙的电子式是______________,乙物质中含有的化学键是_________________;
(3)甲和乙反应的化学方程式是___________________;
(4)A和B形成的化合物之一丙是一种重要的基本化工原料,其产量可以用来衡量一个国家的石油化工发展水平,写出有丙制得高聚物的反应方程式__________________________________,
该反应类型是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值。下列有关叙述不正确的是
A. 5.8g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.02NA
B. 1mol CnH2n-2(n≥2)中所含的共用电子对数为(3n+1)NA
C. 60克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2
D. 在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某未知溶液中![]() =1×1012,且含有大量Al3+和NO3﹣,检验此溶液中是否大量存在以下6种离子:①SiO32﹣、②NH4+、③Fe2+、④Na+、⑤HCO3﹣、⑥Cl﹣,其中不必检 验就能加以否定的离子是 ( )
=1×1012,且含有大量Al3+和NO3﹣,检验此溶液中是否大量存在以下6种离子:①SiO32﹣、②NH4+、③Fe2+、④Na+、⑤HCO3﹣、⑥Cl﹣,其中不必检 验就能加以否定的离子是 ( )
A.①③⑤ B.②③④ C.①②⑥ D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资,广泛用于钢铁工业,电真空照明材料等方面。黑钨矿是一种有开采价值的钨矿石,其主要成分是铁和锰的钨酸盐(常用FeWO4、MnWO4表示)。它的传统冶炼工艺的第一阶段如下图所示:

注:①上述流程中钨的化合价不变 ②钨酸(H2WO4)是一种难溶性酸
(1)写出C的化学式:______;写出生成B的化学方程式:_________
(2)上述流程中,第一次过滤所得滤渣的主要成份除MnO2外,还含有_________,请写出FeWO4在熔融条件下发生反应生成该成分的化学方程式_________
(3)冶炼金属钨是用非整比的钨氧化物为原料,钨元素在其中存在两种价态:+5价和+6价,试确定组成为WO2.7的氧化钨中两种对应价态的钨原子个数的整数比为_____________。
(4)黑钨矿还含少量Si、As的化合物,上述流程需优化(见下图)。向含Na2WO4的滤液中加硫酸调节pH=10后,再除杂净化。

则“净化”过程中,加入H2O2的目的是__________,滤渣Ⅰ的主要成分是____________。
(5)某温度下,Ca(OH)2、CaWO4的相关数据见下表
项目 | CaWO4 | Ca(OH)2 |
-lgc(阴离子) | 4 | 2 |
-lgc(Ca2+) | 6 | 4 |
将钨酸钠溶液加入石灰乳中,发生反应的离子方程式为WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是 ( )
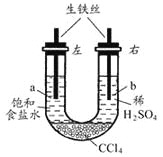
A. a管发生吸氧腐蚀,b管发生析氢腐蚀
B. 一段时间后,a管液面高于b管液面
C. a处溶液的pH增大,b处溶液的pH减小
D. a、b两处具有相同的电极反应式:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为![]() NA
NA
B.1mol碳正离子CH5+所含的电子数为11NA
C.标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA
D.0.5molC3H8分子中含C﹣H共价键2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com