
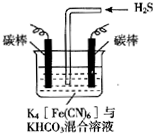
 电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )
电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )| A. | 电解时阳极反应式为[Fe(CN)6]4--e-=[Fe(CN)6]3- | |
| B. | 电解过程中阴极区溶液的pH变大 | |
| C. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 | |
| D. | 通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO32-+H2S=2[Fe(CN)6]4-+2HCO3-+S↓ |
分析 A、电解时阳极发生失电子的氧化反应,先将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高;
B、阴极发生还原反应,电解质溶液中的阴极离子碳酸氢根离子,电离产生氢离子在阴极放电;
C、因后来发生反应为2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,所以整个过程中不需要不断补充K4[Fe(CN)6]与KHCO3;
D、通入H2S时发生反应的离子方程式为2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S.
解答 解:A、电解时阳极发生失电子的氧化反应,先将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高,所以反应为:[Fe(CN)6]4--e-═[Fe(CN)6]3-,故A正确;
B、电解质溶液中的阴极离子碳酸氢根离子,电离产生氢离子在阴极放电,所以电极反应式为2HCO3-+2 e-═H2↑+2CO32-,pH变大,故B正确;
C、因后来发生反应为2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,所以整个过程中需要不断补充K4[Fe(CN)6]与KHCO3,故C错误;
D、通入H2S时发生反应的离子方程式为2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,故D正确;
故选C.
点评 本题主要考查了利用电解原理来判断电极方程式、转移电子数等,难度不大,抓住电解的原理分析阴阳极的反应是解题的根本.


科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:MnO2+2H2O+2e-=Mn(OH)2+2OH- | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥ | B. | ②③④ | C. | ②⑧ | D. | ③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
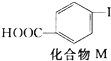 +CH2═CH2$\stackrel{一定条件}{→}$
+CH2═CH2$\stackrel{一定条件}{→}$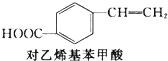 +HI
+HI| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸既属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
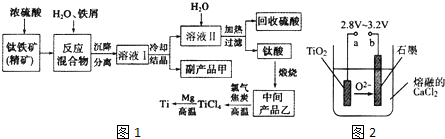
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-14 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
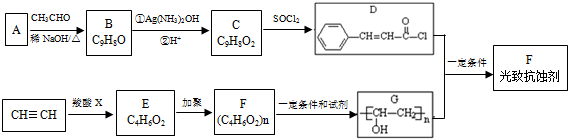
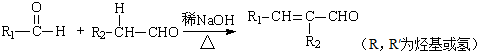
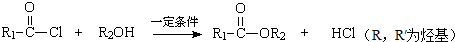
 .
.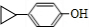 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质变化 | 能量关系 | |
| A | 将充满NO2的针筒置于热水中,气体颜色变深 | 1molN2O4(g)的能量>2molNO2(g)的能量 |
| B | 将NaOH溶液与HCl溶液混合 | 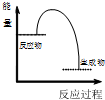 |
| C | 1g气态SiH4在空气中燃烧,生成SiO2 (s)与液态水,放热44.6kJ | SiH4(g)+2O2(g)→SiO2(s)+2H2O(l)+44.6kJ |
| D | 合成氨:N2(g)+3H2(g)?2NH3(g)+92.4kJ | 反应物的总键能>生成物的总键能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ | B. | NH4+ | C. | SO42- | D. | S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离Fe2O3、Al2O3操作依次为溶解、过滤、灼烧 | |
| B. | 粗盐可通过溶解、过滤、蒸发、结晶的方法提纯 | |
| C. | 配制氯化铁溶液,是将FeCl3溶于蒸馏水,再加入一定量的铁粉 | |
| D. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com