
主族元素单质及化合物在许多性质上都存在着递变规律.下列有关说法不正确的是( )
|
| A. | 卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
|
| B. | 氧族元素氢化物稳定性按H2O、H2S、H2Se、H2Te的顺序依次减小 |
|
| C. | 氢化物的沸点按NH3、BiH3、SbH3、AsH3、PH3的顺序依次递减 |
|
| D. | 最高价氧化物对应水化物碱性按NaOH、KOH、RbOH、CsOH的顺序依次增强 |
| 同一主族内元素性质递变规律与原子结构的关系.. | |
| 分析: | A.氯化银是白色固体,溴化银是淡黄色固体,碘化银是黄色固体; B.非金属性越强,则其氢化物的稳定性越强; C.氢化物的相对分子质量越大,则沸点越高,含有氢键的沸点较高; D.金属性越强,则最高价氧化物的水化物的碱性越强. |
| 解答: | 解:A.氯化银是白色固体,溴化银是淡黄色固体,碘化银是黄色固体,所以卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深,故A正确; B.非金属性越强,则其氢化物的稳定性越强,非金属性:O>S>Se>Te,则氧族元素氢化物稳定性按H2O、H2S、H2Se、H2Te的顺序依次减小,故B正确; C.氢化物的相对分子质量越大,则沸点越高,NH3含有氢键沸点较高,则氢化物的沸点按NH3、BiH3、SbH3、AsH3、PH3的顺序依次递减,故C错误; D.金属性越强,则最高价氧化物的水化物的碱性越强,金属性:Na<K<Rb<Cs,则最高价氧化物对应水化物碱性按NaOH、KOH、RbOH、CsOH的顺序依次增强,故D正确; 故选C. |
| 点评: | 本题考查了金属元素和非金属元素性质的递变性,根据元素周期律来分析解答即可,灵活运用基础知识解答,题目难度不大. |


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Na+、K+、MnO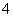 、CO
、CO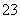
B.c(H+)=1×10-13 mol·L-1的溶液中:Mg2+、Cu2+、SO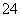 、NO
、NO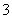
C.0.1 mol·L-1NH4HCO3溶液中:K+、Na+、NO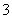 、Cl-
、Cl-
D.0.1 mol·L-1FeCl3溶液中:Fe2+、NH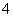 、SCN-、S
、SCN-、S O
O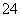
查看答案和解析>>
科目:高中化学 来源: 题型:
粗盐中含Ca2+、Mg2+、Fe3+、SO42—及泥沙等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:① 加入过量的Na2CO3溶液;② 加入过量的BaCl2溶液;③ 加入过量的NaOH溶液;④ 加盐酸调节溶液的pH;⑤ 溶解;⑥ 过滤; ⑦ 蒸发。正确的操作顺序是:
A.⑤①③②④⑥⑦ B.⑤①②③⑥④⑦
C.⑤③①②⑥④⑦ D.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
已知以下两个氧化还原反应的化学方程式:
①Cl2+H2O===HCl+HClO
②2Al+Fe2O3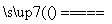 Al2O3+2Fe
Al2O3+2Fe
(1)用单线桥法表示反应②中的电子转移情况:______。
(2)若反应②中每生成1 mol Fe,转移电子的物质的量是:________。
(3)将反应①改写成离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡左移的是( )
|
| A. | 均减半 | B. | 均加倍 | C. | 均增加1mol | D. | 均减少1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氢氟酸在水溶液中建立如下电离平衡:HF⇌H++F﹣,如只改变一个条件一定可以使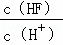 减小的是( )
减小的是( )
|
| A. | 通氯化氢气体 | B. | 加入少量氟化钾固体 |
|
| C. | 加入少氢氧化钠固体 | D. | 通入少量氟化氢气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com