
类推是学习和研究的重要思维方法。下列类推结论正确的是
| 化学事实 | 类推结论 |
A | Al在O2中燃烧生成Al2O3 | Fe在O2中燃烧也生成Fe2O3 |
B | pH=3的盐酸稀释1000倍后pH=6 | pH=6的盐酸稀释1000倍后pH=9 |
C | 用电解熔融MgCl2的方法冶炼金属镁 | 用电解熔融NaCl的方法制取金属钠 |
D | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、太阳能电池板中有高纯硅单质,光导纤维的主要成分也是硅 | B、分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | C、核磁共振谱、红外光谱、紫外光谱和质谱法的综合运用,可用于分析有机物的结构 | D、绿色荧光蛋白在研究癌症发病机制的过程中应用突出,在酸性或碱性条件下可能会失去发光功能 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:实验题
(16分) 硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
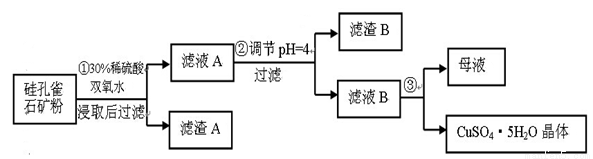
(1)完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +_______+H2O;双氧水的作用是____ 。
(2)步骤②调节溶液pH,可以选用的试剂是______。
A. CuO B.Fe2O3 C.Al2O3 D.Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为 ,滤液B中除Cu2+外, 还含有的金属阳离子是 。
(4)将滤液B通过 、 ,过滤等操作可得到硫酸铜晶体。
(5)测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
下列实验能达到目的的是
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(16分)Ⅰ.已知下列反应的热化学方程式为:
C(s) + O2(g) CO2(g) ΔH1 = -393.5 kJ/mol
CO2(g) ΔH1 = -393.5 kJ/mol
CH3COOH(l) + 2O2(g) 2CO2(g) + 2H2O(l) ΔH 2 = -870.3 kJ/mol
2CO2(g) + 2H2O(l) ΔH 2 = -870.3 kJ/mol
2H2(g) + O2(g) 2H2O(l) ΔH 3 = -571.6 kJ/mol
2H2O(l) ΔH 3 = -571.6 kJ/mol
请计算2C(s) + 2H2(g) + O2(g) CH3COOH(l) ΔH 4 = 。
CH3COOH(l) ΔH 4 = 。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2 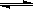 2(t-BuNO)
2(t-BuNO)
该温度下该反应在CCl4溶剂中的平衡常数为1.4 mol/L。
(1)向1 L正庚烷中加入0.50 mol (t-BuNO)2,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1 L)。反应在前10 min内的平均速率为v(t-BuNO)= 。计算上述反应的平衡常数K。(写出计算过程,计算结果保留3位有效数字)
(2)有关反应:(t-BuNO)2 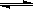 2(t-BuNO) 的叙述正确的是________
2(t-BuNO) 的叙述正确的是________
A.压强越大,反应物的转化率越大 B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。
时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.09 | 0.094 | 0.096 | 0.096 |

Ⅲ.甲醇燃料电池的电解质溶液是KOH溶液。则通入甲醇的电极反应式为 。若通空气的电极上有32g O2参加反应,则反应过程中转移了______ mol e-。
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:实验题
(16分)碘元素的单质和化合物在现实生产生活中应用广泛。
(1)碘化钾(KI)是常用的还原剂。某研究性学习小组利用碘酸钾(KIO3)测定碘化钾的浓度。在10.00mL的KI溶液中逐滴滴入用硫酸酸化的 KIO3溶液,溶液颜色不再变化后,用Na2S2O3溶液滴定生成的I2(使用淀粉做指示剂),消耗0.2000mol·L-1 Na2S2O3溶液30.00mL。
滴定过程发生的离子方程式如下:2S2O32-+I2===S4O62-+2I-;
①写出本实验中碘酸钾和碘化钾反应的化学方程式,并标出电子转移的方向和数目:_______________________________________________________。
②滴定终点判断 ;
③测定的KI溶液浓度是 mol·L-1。
(2)探究酸性KIO3溶液的与KI溶液反应中KIO3浓度和温度对反应速率的影响,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
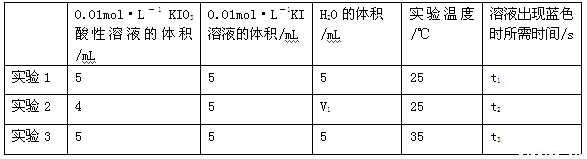
①由小到大比较t1、t2、t3的大小 ;表中V1= mL;
②用Na2S2O3标准溶液滴定生成的I2,滴定前排气泡时,应选用下图中的_________。
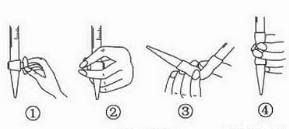
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:选择题
某小组为研究电化学原理,设计了下图所示的电化学装置,电极I为锌,其他电极均为石墨,盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液。下列叙述正确的是
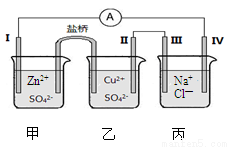
A.电子由电极IV通过外电路流向电极I
B.装置工作过程中III电极周围出现红色
C.电极II发生还原反应
D.盐桥中Cl—向乙池移动
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:实验题
(12分)现有一块铁碳合金,某化学兴趣小组为了测定合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置进行实验(夹持仪器已省略),请你参与此项活动并回答相应的问题。
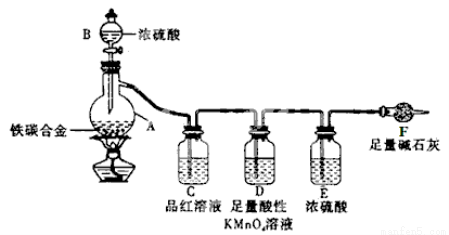
(1)以下有关合金的说法,正确的是 (填写字母)
A.铁碳合金的熔点高于纯铁和碳
B.铁碳合金的熔点介于纯铁和碳之间
C.铁碳合金的硬度大于纯铁
D.其他条件相同时,铁碳合金的耐腐蚀性强于纯铁
(2)按图示连接好装置,检验气密性,加入药品,称量F的质量,将m g合金样品放入A中,再通过B加入过量的浓硫酸。未点燃酒精灯前,A中无明显现象,其原因是: 。
(3)点燃酒精灯,反应一段时间后,C、D中可观察到明显的现象。写出合金样品在A中反应的化学方程式_______ , _____________________________。
(4)C中的现象是_______________________,D中足量酸性KMnO4 溶液的作用是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
设阿伏加德罗常数为NA,下列说法正确的是( )
A.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
B.常温常压下,14g氮气中含有 NA个原子
C.1mol/LNaCl溶液中含有NA个氯离子
D.等质量的丙烯和乙烯气体中氢原子的个数均为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com