
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因:______________;农业上用石膏降低其碱性的反应原理:__________。
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”“<”或“=”)n。
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=__________。
(4)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
【答案】Na2CO3+H2O![]() NaHCO3+NaOH Na2CO3+CaSO4=CaCO3+Na2SO4 < 1.0×10-8 mol·L-1 中
NaHCO3+NaOH Na2CO3+CaSO4=CaCO3+Na2SO4 < 1.0×10-8 mol·L-1 中 ![]()
【解析】
(1)碳酸钠在溶液中水解使溶液显碱性,导致盐碱地呈碱性,水解的化学方程式为Na2CO3+H2O ![]() NaHCO3+NaOH;向盐碱地中加入石膏(CaSO4),CaSO4和Na2CO3反应生成硫酸钠和碳酸钙,反应的化学方程式为:Na2CO3+CaSO4=CaCO3+Na2SO4,盐碱地中碳酸钠的浓度减小,使盐碱地中氢氧根浓度减小,碱性减弱,故答案为:Na2CO3+H2O
NaHCO3+NaOH;向盐碱地中加入石膏(CaSO4),CaSO4和Na2CO3反应生成硫酸钠和碳酸钙,反应的化学方程式为:Na2CO3+CaSO4=CaCO3+Na2SO4,盐碱地中碳酸钠的浓度减小,使盐碱地中氢氧根浓度减小,碱性减弱,故答案为:Na2CO3+H2O ![]() NaHCO3+NaOH;Na2CO3+CaSO4=CaCO3+Na2SO4;
NaHCO3+NaOH;Na2CO3+CaSO4=CaCO3+Na2SO4;
(2)氨水中存在电离平衡,稀释促进一水合氨的电离,使溶液中氢氧根的物质的量增加,而氢氧化钠在溶液中完全电离,不存在电离平衡,所以要使稀释的后的pH相等,氨水稀释的倍数大于氢氧化钠溶液,即m<n,故答案为:<;
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中醋酸的电离程度大于醋酸根的水解程度,醋酸电离出的氢离子抑制水的电离,则由水电离出来的c(OH-)=![]() mol/L=1×10-8mol/L,故答案为:1×10-8mol/L;
mol/L=1×10-8mol/L,故答案为:1×10-8mol/L;
(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3H2O的电离常数Kb= 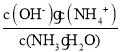 =
=![]() =
=![]() ,故答案为:中;
,故答案为:中;![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
A.盐酸的导电能力一定比醋酸的导电能力强
B.一定量的锌粒与足量稀硫酸反应,向反应混合液中加入醋酸钠固体,产生![]() 速率减小,
速率减小,![]() 体积减小
体积减小
C.相同温度下![]() 氨水
氨水![]() 的浓度比
的浓度比![]() 溶液
溶液![]() 的浓度小
的浓度小
D.![]() 氨水可以使酚酞试液变红,证明
氨水可以使酚酞试液变红,证明![]() 是弱碱
是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiMn2O4是一种无污染、成本低的锂离子电池电极材料,某研究小组利用柠檬酸配合法制备LiMn2O4。
(1)按一定配比将醋酸锂(CH3COOLi)和醋酸锰[(CH3COO)2Mn]溶液混合后,加入柠檬酸(分子式C6H8O7)溶液中配成混料。用6 mol·L-1氨水调节pH至6.5~9,在75℃~85℃水浴中加热,制得柠檬酸配合物(其中Mn为+2价)。装置如图所示(加热和夹持装置已略去)。
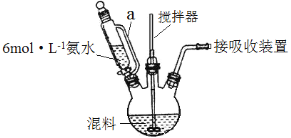
①滴液漏斗中a管的作用是________。
②实验室用14.8 mol·L-1浓氨水配制250 mL 6mol·L-1的氨水需要的仪器有胶头滴管、烧杯、玻璃棒、量筒、________。
③调节pH至6.5~9是为了促进柠檬酸电离。pH不能大于9的原因是______。
④用水浴加热的目的是__________。
(2)将制得的配合物在烘箱中真空干燥得到固态柠檬酸配合物前驱体,研磨后焙烧,得LiMn2O4。
①柠檬酸配合物前驱体应放在_______(填仪器名称)中焙烧。
②焙烧需要在空气中进行的原因是__________。
③焙烧产生的气体是________。
(3)测定产品中锰的含量:准确称取0.1000 g的产品试样,加入足量浓盐酸溶液加热溶解,驱赶溶液中残留的Cl2,配成250 mL溶液。取25.00 mL溶液于锥形瓶中用0.02000 mol·L-1EDTA(Mn2+与EDTA按1:1络合)滴定,消耗EDTA溶液的体积V mL。样品中锰的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是
A.Na2S2O3溶液中加入稀硫酸的离子方程式为:2S2O32-+4H+![]() SO42-+ 3S↓+ 2H2O
SO42-+ 3S↓+ 2H2O
B.用TiCl4制备TiO2的反应可表示为:TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
C.滴加甲基橙试液后呈红色的溶液中可以大量共存: Na+、 CO32-、 K+、 AlO2-
D.25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷![]() 广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸
广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸![]() 。请回答下列问题:
。请回答下列问题:
![]() 已知亚磷酸
已知亚磷酸![]() 为二元弱酸,则
为二元弱酸,则![]() 溶液中,各离子浓度的大小关系为________。
溶液中,各离子浓度的大小关系为________。
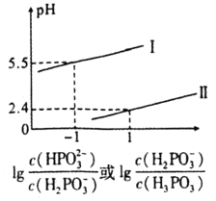
![]() 常温下,将NaOH溶液滴加到亚磷酸
常温下,将NaOH溶液滴加到亚磷酸![]() 溶液中,混合溶液pH与离子浓度变化的关系如图所示。则表示
溶液中,混合溶液pH与离子浓度变化的关系如图所示。则表示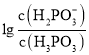 的是曲线________
的是曲线________![]() 填“Ⅰ”或“Ⅱ”
填“Ⅰ”或“Ⅱ”![]() ,亚磷酸
,亚磷酸![]() 的
的![]() ________,反应
________,反应![]() 的平衡常数值是________。
的平衡常数值是________。
![]() 工业上生产三氯氧磷的同时会产生含磷废水
工业上生产三氯氧磷的同时会产生含磷废水![]() 主要成分为
主要成分为![]() 、
、![]() 。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中
。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中![]() ,则溶液中
,则溶液中![]() ________
________![]() 。
。![]() 已知
已知![]() )
)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子个数之和是氧原子数的5倍。已知:各有机物间存在如下转化关系:
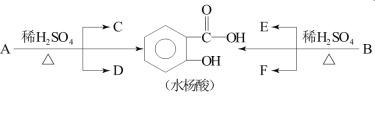
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(1)A的分子式是________。
(2)E中所含官能团的名称是________;完全燃烧时,1 mol D与1 mol下列________的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(3)写出水杨酸与小苏打反应的化学方程式是___________;写出C与F反应的化学方程式是_________。
(4)同时符合下列要求的同分异构体有___________种。
①与A互为同分异构体;
②能发生水解反应;
③苯环上有两个取代基,且苯环上的一氯代物只有1种。
(5)1 mol 上述(4)中的一种有机物X,能与4 mol NaOH发生反应,写出此反应的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻硝基甲苯和对硝基甲苯能被用作爆炸品检测的示踪剂。某探究小组利用下图反应和装置制备一硝基甲苯。
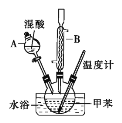
实验中可能用到的数据:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:
①按体积比1∶3配制浓硫酸与浓硝酸的混合物80mL;②在250mL的三颈烧瓶中加入30mL(26g)甲苯,按图所示装好药品和其他仪器;③向三颈烧瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);④控制温度约为50℃,反应大约10min,三颈烧瓶底有大量淡黄色油状液体出现;⑤分离出一硝基甲苯的总质量为27.20g。
请回答下列问题:
(1)使用仪器A前必须进行的操作是_______。
(2)该实验采用水浴加热,水浴加热的优点有:受热均匀、_______。
(3)配制混酸的方法是分别量取20mL浓硫酸和60mL浓硝酸,将浓_______倒入烧杯中,浓_______沿着烧杯内壁缓缓注入,并不断搅拌。
(4)控制温度约为50℃时,反应生成的产物一硝基甲苯是邻硝基甲苯和对硝基甲苯混合物,写出该反应生成对硝基甲苯的化学方程式_______。
(5)分离反应后产物的方案如下:

①操作1的名称为_______。
②操作2中,下列仪器选择及安装正确的是_______(填字母)。
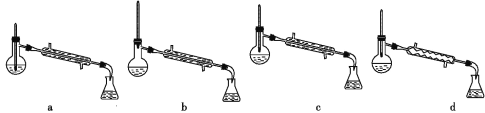
(6)该实验中一硝基甲苯的产率为_______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工光合系统装置(如图)可实现以CO2和 H2O 合成CH4。下列有关说法不正确的是( )
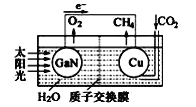
A.该装置中GaN为负极
B.电池工作时H+向Cu电极移动
C.Cu电极的电极反为: CO2+8e-+8H+═CH4+2H2O
D.该装置中涉及的能量转化形式只有两种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com