
分析 (1)根据三行式,结合K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$代入计算;
(2)在其它条件不变时,在体积恒定的容器中,再充入0.5molNO2,相当于增大压强;
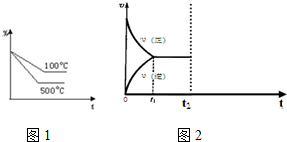
(3)由图可知,温度越高,NO2的转化率越小,说明升高温度平衡逆向进行;
(4)平衡建立后,在t2时刻将容器的体积进行压缩,压缩后,平衡向减弱浓度变大的方向移动,但未抵消,所以容器中气体的颜色将变深;加压正逆反应速率都加快,但正反应速率增加的幅度更大,由此分析图.
解答 解:(1)2NO2 ?N2O4
起始浓度:1mol/L 0
变化量:0.36mol/L 0.18mol/L
平衡浓度:0.64mol/L 0.18mol/L
所以K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.18}{0.6{4}^{2}}$=0.44,故答案为:0.44;
(2)在其它条件不变时,在体积恒定的容器中,再充入0.5molNO2,相当于增大压强,平衡正向移动,NO2的转化率将变大,故答案为:变大;
(3)由图可知,温度越高,NO2的转化率越小,说明升高温度平衡逆向进行,逆反应是吸热反应,正反应是放热反应,所以△H<0,故答案为:<;
(4)平衡建立后,在t2时刻将容器的体积进行压缩,压缩后,平衡向减弱浓度变大的方向移动,但未抵消,所以容器中气体的颜色将变深;加压正逆反应速率都加快,但正反应速率增加的幅度更大,所以图象为: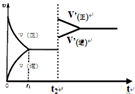 ,故答案为:变深;
,故答案为:变深; .
.
点评 本题考查化学平衡常数的计算、外界条件改变平衡移动的影响、根据图象判断化学反应的热效应和作图,综合性强,但比较容易.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:多选题
| A. | 硫化亚铁溶于足量稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O | |
| C. | FeCl2溶液中通入少量氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LBr2所含溴原子的数目为2NA | |
| B. | 常温下,NO2与足量的水反应生成0.1molNO,转移的电子数为0.2NA | |
| C. | 1 mol 乙醇中含有的C-H键的数目为6NA | |
| D. | 1mol•L-1的NaClO溶液中含有的ClO-数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阴极和阳极的质量始终保持不变 | |
| B. | 溶液中的Cu2+、H+和Na+都要移向阴极,但在阴极优先放电的离子是Cu2+ | |
| C. | 溶液中的Cl-在阳极上完全放电后,溶液中的SO${\;}_{4}^{2-}$接着在该极上放电生成O2 | |
| D. | 电解过程中阴极上始终有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NO2):V(O2)=2:1 | B. | V(NO):V(O2)=2:1 | ||
| C. | V(NH3):V(O2)=2:1 | D. | V(NO2):V(NO):V(O2)=1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | B. | H+、K+、HCO${\;}_{3}^{-}$、Ca2+ | ||
| C. | Ba2+、Mg2+、OH-、Cl- | D. | Fe3+、NH${\;}_{4}^{+}$、S2-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com