
| 序号 | 物质 | 试剂 | 分离方法 |
| ① | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ② | 溴苯(溴) | NaOH溶液 | 分液 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(环己烷) | 水 | 分液 |
| A. | ①② | B. | ①③ | C. | ②③ | D. | ④③ |
分析 ①乙酸乙酯在氢氧化钠溶液中能发生水解反应生成乙酸钠和乙醇,乙酸和氢氧化钠反应生成乙酸钠;互溶的液体采用蒸馏方法分离;
②溴和NaOH反应生成可溶性的钠盐,溴苯和氢氧化钠溶液不反应且分层,不互溶的液体采用分液方法分离;
③水和生石灰反应生成氢氧化钙,乙醇和生石灰不反应,增大二者沸点;
④环己烷和苯都不溶于水且环己烷和苯互溶.
解答 解:①乙酸乙酯在氢氧化钠溶液中能发生水解反应生成乙酸钠和乙醇,乙酸和氢氧化钠反应生成乙酸钠;互溶的液体采用蒸馏方法分离,所以不能用NaOH溶液除去乙酸乙酯中的乙酸,应该用饱和碳酸钠溶液,然后采用分液方法分离,故错误;
②溴和NaOH反应生成可溶性的钠盐,溴苯和氢氧化钠溶液不反应且分层,不互溶的液体采用分液方法分离,所以可以用氢氧化钠溶液除去溴苯中的溴,然后采用分液方法分离,故正确;
③水和生石灰反应生成氢氧化钙,乙醇和生石灰不反应,增大二者沸点,然后采用蒸馏方法分离,故正确;
④环己烷和苯都不溶于水且环己烷和苯互溶,所以不能用水作除杂剂,应该用蒸馏方法分离,故错误;
故选C.
点评 本题考查物质分离和提纯,为高频考点,明确物质性质是解本题关键,利用物质差异性选取合适的除杂剂,难点是除杂剂的选取,知道常见物质分离提纯方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 除去苯中的少量溴:加入NaOH溶液,振荡、静置分层后,除去水层 | |
| B. | 除去乙酸乙酯中残留的乙醇:加入乙酸和浓硫酸,然后加热,再分液 | |
| C. | 将红热的铜丝迅速插入乙醇中,反复多次,可观察到铜丝表面变黑,并能闻到香味 | |
| D. | 向淀粉溶液中加入少量稀硫酸并加热,为测定其是否发生水解和是否完全水解,需使用到的试剂有碘水和新制Cu(OH)2悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 最外层电子数比次外层电子数少5个电子 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H14 | B. | C7H16 | C. | C8H18 | D. | C9H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
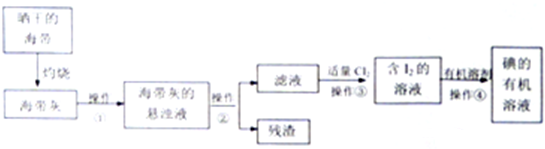
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 试剂 | T1/℃ | T2/℃ | T3/℃ |
| NaCO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
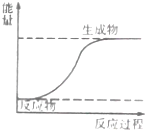
| A. | 如图表示化学反应过程中释放能量 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 化学反应中一定存在化学键的变化 | |
| D. | 原电池是将化学能转变成电能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com