
【题目】(1)已知某烷烃的键线式为![]() ,
,
①该烷烃分子式为_____。
②若该烷烃是由烯烃和 1molH2加成得到的,则原烯烃的结构有_____种。
③该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有______种。(此小题不包括立体异构)
(2)沧州铁狮酒的主要成分是我们学习的有机物——乙醇,请写出该有机物官能团的名称______,该官能团的电子式______。我们还学习了与乙醇结构相似的一系列有机物如:
A.CH3OH B.(CH3)3CCH2OH C.(CH3)3COH D.(CH3)2CHOH等有机物(填字母)
①能氧化成醛的是_______ ②不能发生消去反应形成烯的是_________③能氧化成酮的是_____
【答案】 C7H16 3 5 羟基 ![]() AB B D
AB B D
【解析】A、①该烷烃分子式为C8H18;②若该烷烃是由烯烃1molH2加成得到的,则原烯烃的结构有3种,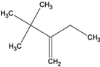 、
、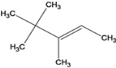 、
、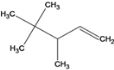 ;③该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有5种,如图所示
;③该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有5种,如图所示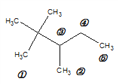 ;(2)乙醇官能团的名称羟基,其电子式为
;(2)乙醇官能团的名称羟基,其电子式为![]() ;醇羟基所在的碳原子上一定要有氢原子,才能被氧化,①能氧化成醛的醇羟基所在的碳原子上一定要有2个氢原子,符合条件的有AB;②消去反应发生的条件: 醇分子中,连有羟基(-OH)的碳原子必须有相邻的碳原子且此相邻的碳原子上还必须连有氢原子时,才可发生消去反应而形成不饱和键。不能发生消去反应形成烯的是B;③能氧化成酮的醇羟基所在的碳原子上只能有1个氢原子,能氧化成酮的是D。
;醇羟基所在的碳原子上一定要有氢原子,才能被氧化,①能氧化成醛的醇羟基所在的碳原子上一定要有2个氢原子,符合条件的有AB;②消去反应发生的条件: 醇分子中,连有羟基(-OH)的碳原子必须有相邻的碳原子且此相邻的碳原子上还必须连有氢原子时,才可发生消去反应而形成不饱和键。不能发生消去反应形成烯的是B;③能氧化成酮的醇羟基所在的碳原子上只能有1个氢原子,能氧化成酮的是D。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】酚酞是白色结晶,在空气中稳定,几乎不溶于水,常用做酸碱指示剂,其结构简式如下图:

(1)从结构上分析,酚酞可看作____(填序号)。
a.烯烃 b.芳香烃 c.醇类物质 d.酚类物质e.羧酸类物质f.酯类物质
(2)酚酞的分子式为____________。
(3)1个酚酞分子中含有____个饱和碳原子;1mol酚酞可以与_____mol金属钠发生反应。
(4)实验室中常用的酚酞溶液,其溶剂是_______(填“水”、“乙醇”或“四氯化碳”),酚酞可以看作一种弱酸,做指示剂时不能滴加太多,请写出在氢氧化钠溶液中滴加几滴酚酞后的反应方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或设计中,可行的是( )
A. CO2通入足量BaCl2溶液中,产生白色沉淀
B. 除去O2中混有的H2,可将气体通过灼热CuO
C. 利用分液斗可分离酒精和氯化钠的混合物
D. 加稀盐酸后过滤,除去铜扮中没有的少量镁粉和铝粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界上最早现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载。回答下列问題:
(1)基态Zn原子的电子占据能量最高的能层符号为_________,与Zn同周期的所有副族元素的基态原子中,最外层电子数与Zn相同的元素有_________种。
(2)硫酸锌溶于过量的氨水可形成[Zn(NH3)4]SO4溶液。
①在[Zn(NH3)4]SO4中,阴离子的中心原子的轨道杂化类型为______________;
②在[Zn(NH3)4]SO4中,与Zn2+形成配位键的原子是______________________(填元素名称);
③写出一种与SO42-互为等电子体的分子的化学式__________________;
④NH3极易溶于水,除因为它们都是极性分子外,还因为__________________。
(3)Zn与S所形成化合物晶体的晶胞如图所示。

①与Zn原子距离最近的Zn原子有___________个;
②该化合物的化学式为___________;
③已知该晶体的晶胞参数a=541 pm,其密度为_______g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比是8∶1∶2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是
A.1∶1∶1 B.1∶4∶2 C.1∶2∶4 D.1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸在医药和石化工业上有广泛用途。如图所示是模拟工业制备氢溴酸粗产品并精制的流程:

根据上述流程回答下列问题:
(1)操作Ⅱ的名称是_______________;
(2)混合①中发生反应的离子方程式为____________________________________________;
(3)操作Ⅲ一般适用于分离____________混合物(填序号)。
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是____________________________________________;
(5)纯净的氢溴酸为无色液体,但实际工业生产中制得的氢溴酸带有淡淡的黄色。甲同学认为工业氢溴酸呈淡黄色是因为其中含有Fe3+,验证甲同学假设所用的试剂是________________;若其中含有Fe3+ ,现象是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量是衡量一个国家石油化工发展水平标志,下图是以A为原料生产某些化工产品的转化关系图.

据此回答下列问题.
(1)写出A的结构简式_________________.D中官能团的名称________________
(2)反应①的反应类型___________________
(3)写出反应③的方程式的______________________________________________________
(4)写出C的属于酯类的同分异构体的结构简式_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中反应属于同一种反应类型的是( )
A. 由苯制环己环烷由氯乙烯制备聚氯乙烯
B. 乙烯使酸性高锰酸钾褪色、乙醇制乙醛
C. 苯和液溴在铁粉催化下反应、乙炔使溴水褪色
D. 乙醇与浓硫酸共热制乙烯、乙醇与浓硫酸共热制乙醚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.海洋植物如海带中含有丰富的碘元素,从海带中提取碘的实验需经过如下五个主要步骤:
①将海带灰转移到小烧杯中,向其中加入10 mL蒸馏水,搅拌、煮沸2—3 min;
②取3 g左右的干海带,剪碎后用酒精润湿,放入坩埚中,灼烧海带至完全变成灰烬,停止加热,冷却;
③向溶液中加入四氯化碳,振荡、静置、分液,得到含碘的有机溶液;
④向含碘离子的溶液中滴入几滴稀硫酸,再加入1 mL 3%H2O2溶液;
⑤过滤,得到含碘离子的溶液;
请回答下列问题:
(1)实验步骤的合理顺序是_______________(填序号)
(2)步骤③中使用的主要仪器是____________
(3)步骤①中搅拌、煮沸2—3 min的目的是________________
(4)步骤④中反应的离子方程式是________________________________
Ⅱ.碲(Te,是第六主族元素)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下:

已知TeO2微溶于水,易溶于较浓的强酸和强碱。
(1)“碱浸”时发生反应的离子方程式为__________________
(2)碱浸后的“滤渣”可以部分溶于稀硝酸,发生反应的化学方程式是___________________________________
(3)“沉碲”时需控制溶液的pH值生成TeO2沉淀。酸性不能过强,其原因是__________________________________________
(4)“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是_________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com