
元素W、X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为34,M原子的最外层电子数与次外层电子数之比为34,且M原子的质子数是Y原子的2倍;X元素的最高正价与最低负价绝对值之差为2;N-、Z+、W+的半径逐渐减小;化合物WN常温下为气体,据此回答下列问题:
(1)W与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:
___________________________________________________________。
(2)下图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:_________。
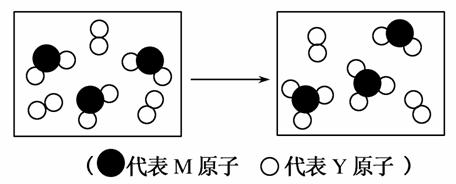
(3)A、B均为由上述六种元素中的三种元素组成的强电解质,且组成元素的原子个数之比均为1:1:1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为________,B的电子式是________。
(4)如对盛有气体XY2的密闭容器(带可移动的活塞)进行压缩操作,产生的现象是_________________________________________,原因是______
_____________________________________。
解析 Y原子最外层电子数与核外电子总数之比为34,M原子的最外层电子数与次外层电子数之比为34,且M原子的质子数是Y原子的2倍,可推出Y为O,M为S。X元素的原子序数小于Y且X元素的最高正价与最低负价绝对值之差为2,可推出X为N。N-、Z+、W+的半径逐渐减小,化合物WN常温下为气体,可推出W为H,Z为Na,N为Cl。W与Y形成的10电子分子为H2O,18电子分子为H2O2。NaOH、NaClO和NaHS均为强电解质,NaOH能抑制水的电离,NaClO和NaHS能促进水的电离。
答案 (1)2H2O2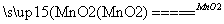 2H2O+O2↑
2H2O+O2↑
(2)2SO2+O2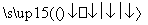 2SO3
2SO3
(3)NaOH Na+-、Na+-(写出一种即可)
(4)气体颜色先变深,再逐渐变浅 压缩容器将使有色气体NO2浓度增大,颜色加深,又因平衡2NO2(g)N2O4(g)向右移动,颜色变浅


科目:高中化学 来源: 题型:
镍氢电池( NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。
NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。
已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO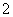
下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程中OH-从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①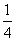 CaSO4(s)+CO(g)
CaSO4(s)+CO(g) 
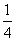 CaS(s)+CO2(g) ∆H1= —47.3kJ∙mol-1
CaS(s)+CO2(g) ∆H1= —47.3kJ∙mol-1
② CaSO4(s)+CO(g)  CaO(s)+CO2(g) +SO2(g) ∆H2= +210.5kJ∙mol-1
CaO(s)+CO2(g) +SO2(g) ∆H2= +210.5kJ∙mol-1
③ CO(g) 
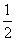 C(s)+
C(s)+ 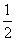 CO2(g) ∆H3= —86.2kJ∙mol-1
CO2(g) ∆H3= —86.2kJ∙mol-1
(1)反应2CaSO4(s)+7CO(g)  CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(
CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2( g)的∆H=___________(用∆H1、∆H2和∆H3表示)
g)的∆H=___________(用∆H1、∆H2和∆H3表示)
( 2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图18,结合各反应的∆H,归纳lgK-T曲线变化规律:
2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图18,结合各反应的∆H,归纳lgK-T曲线变化规律:
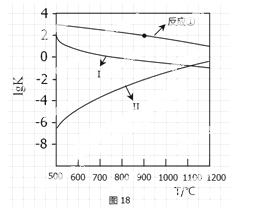
a)_______________________________;b)____________________________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900℃达到平衡,c平衡(CO)=8.0×10-5 mol∙L-1,计算CO的转化率(忽略副反应 ,结果保留两位有效数字)。
,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入____________。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为_______________;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知R元素的某种同位素能形成化合物AmRn,其中A的化合价为+n。该化合物中一个R微粒的核外电子数为a,核内中子数为b,则该同位素的原子符号是( )
A.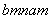 R B.
R B.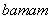 R
R
C.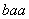 R D.
R D. R
R
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )
| X | Y |
| Z | W |
A.若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B.若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
C.若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
D.若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸浓度为4mol/L,稀硝酸的浓度为2mol/L。取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到气体体积为(假设HNO3只被还原为NO)( )
A.0.224L B.0.448L C.0.672L D.0.896L
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.1mol/L醋酸溶液的pH=3。将该温度下0.2 mol/L醋酸溶液和 0.2mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7,下列说法正确的是( )
A.该温度下,0.0lmol/L醋酸溶液的pH=4
B.该温度下,用0.1mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1∶10
C.该温度下,0.01mol/L醋酸溶液中由水电离出的c(H+)=10-11mol/L
D.该温度下,0.2mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液中c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C10H12O2的有机物,满足以下两个条件:①苯环上有两个取代基,②能与NaHCO3反应生成气体。则满足条件的该有机物的同分异构体有( )
A.9 B.10 C.12 D.15
查看答案和解析>>
科目:高中化学 来源: 题型:
请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生氢气的体积(大于25 mL),并检验氯气的氧化性。
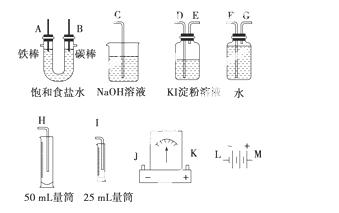
(1)A极发生的电极反应式是________________________________________________,
B极发生的电极反应式是__________________________________________________。
电解饱和食盐水的化学方程式______________________________________________。
(2)电源、电流表与A、B两极的正确连接顺序为:L→( )→( )→( )→( )→M。
(3)设计上述气体实验装置时,各接口的正确连接顺序为:________接________、________接A、B接________、________接________。
(4)在实验中,盛 有KI淀粉溶液的容器中发生反应的离子方程式为__________________________________________________。
有KI淀粉溶液的容器中发生反应的离子方程式为__________________________________________________。
(5)已知饱和食盐水50 mL,某时刻测得H2体积为5.6 m L(标准状况)。此时溶液pH约为__________________________________________________。
L(标准状况)。此时溶液pH约为__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com