
| A. | 铝片与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 硫在氧气中的燃烧反应 |
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
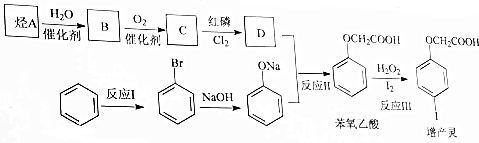
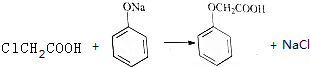 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
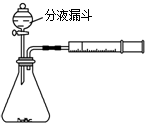 学习了“化学反应的速率是通过实验测得的”以后,某同学设计了下列实验:
学习了“化学反应的速率是通过实验测得的”以后,某同学设计了下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y原子M电子层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的+1价阳离子的核外有3层电子且各层均处于全满状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N4是N2的同素异形体 | |
| B. | 等质量的N4和N2,N4体积是N2体积的一半 | |
| C. | 相同质量的N4和N2所含原子个数比为1:2 | |
| D. | N4的摩尔质量是56g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
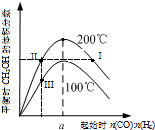 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )| A. | 反应CO(g)+2H2(g)?CH3OH(g)的△H<0 | |
| B. | 图示a点n(CO):n(H2)=0.5,CO转化率最高 | |
| C. | 若在状态Ⅰ和Ⅱ时,再向体系中充入He,重新达到平衡:c(CH3OH,状态Ⅱ)=c(CH3OH,状态Ⅰ) | |
| D. | 正反应速率ν正:ν正(状态Ⅱ)>ν正(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
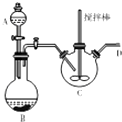 乳酸(
乳酸(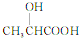 )是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶.
)是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶.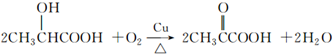 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 离子的还原性:Y2-<Z- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 粒子半径:cY2->dZ->bX+>aW3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol C nH 2n+2中所含有的共价键数目为(3n+1)N A | |
| B. | 14g 乙烯和丙烯的混合物中含有原子的数目为N A | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为 $\frac{5}{22.4}$NA | |
| D. | 1.5g 甲基(-CH 3)所含有的电子数是 N A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com