
| A. | 取代反应 | B. | 加成反应 | C. | 酯化反应 | D. | 氧化反应 |
分析 根据题中信息“绿色化学”工艺的要求:反应物全部转化为期望的产物,使原子的利用率达到100%,可知反应只生成一种生成物,据此即可解答.
解答 解:“绿色化学”工艺的要求:反应物全部转化为期望的产物,使原子的利用率达到100%,可知反应只生成一种生成物.
A、取代反应的产物有两种,故A错误;
B、加成反应的产物只有一种,故B正确;
C、酯化反应的产物除了酯类还有水生成,故C错误;
D、氧化反应的产物不一定只有一种,比如乙醇的催化氧化,产物有乙醛和水,原子经济百分数不是100%;但乙醛被催化氧化,产物只有乙酸,则原子经济百分数达到100%,即氧化反应的原子经济百分数有可能达到100%,故D正确.
故选BD.
点评 本题主要考查了绿色化学的概念,掌握反应中产物的种类与原子利用率100%的关系是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①② | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1NaCl溶液中含有NA个Na+ | |
| B. | 25℃,101kPa,64gSO2中含有的原子数为3NA | |
| C. | 在常温常压下,22.4LCl2含有的分子数为NA | |
| D. | 标准状况下,11.2LCCl4含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17 g甲基(-14CH3)所含电子数为10NA | |
| B. | 标准状况下,0.56L丙烷中含有共价键的数目为0.2NA | |
| C. | 在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为5NA | |
| D. | 0.1mol9038Sr原子中含中子数为3.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H4 C3H4 | B. | C2H6C3H6 C4H6 | C. | CH4 C2H6 C3H8 | D. | C2H4 C2H6 C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子中,C、H原子个数比为1:2 | |
| B. | 乙烯易发生加成反应且1mol乙烯加成时只需1mol溴 | |
| C. | 乙烯能被氧化 | |
| D. | 乙烯完全燃烧生成等物质的量的CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都能设计成原电池 | |
| B. | 原电池两极均发生还原反应 | |
| C. | 原电池中的阳离子向负极移动 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
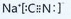 .
.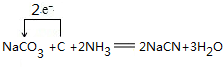 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com