
����Ŀ����¯�����з����Ļ�����Ӧ֮һ���£�FeO(s) +CO(g)![]() Fe(s)+CO2(g)������Ӧ�����ȷ�Ӧ������֪1100��ʱK=0.263��
Fe(s)+CO2(g)������Ӧ�����ȷ�Ӧ������֪1100��ʱK=0.263��
��1���¶����ߣ���ѧƽ���ƶ���ﵽ�µ�ƽ�⣬��¯��CO2��CO�������ֵ________��ƽ�ⳣ��Kֵ___________ ��ѡ�������С�����䡱����
��2��1100��ʱ��ø�¯��c��CO2��=0.025mol��L��1��c��CO��=0.1mol��L��1������������£��÷�Ӧ�Ƿ��ڻ�ѧƽ��״̬_________ ��ѡ��ǡ�������ʱ����ѧ��Ӧ������v(��)_____ v(��)��ѡ����ڡ���С�ڡ����ڡ�������ԭ����____________��
���𰸡����� ���� �� ���� Qc < K��ƽ��������Ӧ�����ƶ�
��������
��1�������¶�ƽ�������ȷ����ƶ�������ƽ���ƶ��ķ����жϸ�¯��CO2��CO�������ֵ�仯�Լ�ƽ�ⳣ��Kֵ��
��2����Ӧ�����ȷ�Ӧ������Ũ���̣���ƽ�ⳣ���Ƚϣ����жϷ�Ӧ�Ƿ�ﵽƽ��״̬���жϷ�Ӧ���еķ���
��1����ѧ��Ӧ�����ȷ�Ӧ���¶����ߣ���ѧƽ��������У���ѧƽ���ƶ���ﵽ�µ�ƽ�⣬��¯��CO2��CO�������ֵ�������ݻ�ѧƽ�ⳣ������ͼ���ʽ�ж�ƽ�ⳣ�����ʴ�Ϊ����������
��2��1100��ʱ��ø�¯��c��CO2��=0.025molL-1��c��CO��=0.1molL-1������������£��Ѷ���Qc= c��CO2��/ c��CO��=0.025molL-1/0.1molL-1=0.25��K=0.263�����Դ�ʱ��Ӧδ�ﵽ��ѧƽ�⣬��Ӧ������У�����Ӧ���ʴ����淴Ӧ���ʣ��ʴ�Ϊ�����ڣ�Qc < K��ƽ��������Ӧ�����ƶ�


 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���ѧ�����Ͷ���ͬ���ǣ� ��
A. HCl��NaOHB. H2S��MgSC. H2O��CO2D. H2SO4��NaNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵó���Ӧʵ����۵���
ѡ�� | �� | �� | �� | ʵ����� |
|
A | Ũ���� | Na2CO3 | Na2SiO3��Һ | �ǽ����ԣ� C>Si | |
B | ʳ��ˮ | ��ʯ | ��ˮ | ��Ȳ�����巢���ӳɷ�Ӧ | |
C | Ũ���� | Al | NaOH��Һ | ����Ũ���ᷴӦ������NO2 | |
D | Ũ���� | Na2SO3 | KMnO4������Һ | SO2���л�ԭ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ֻ���й��ۼ����ǣ� ��
A.NaCl��HCl��H2O��NaOHB.Cl2��Na2S��HCl��SO2
C.Na2O2��H2O2��H2O��O3D.HBr��CO2��H2O��CS2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ������ȷ��ӳ��Ӧ�ı仯��ϵ���ǣ� ��
A. ��һ������ϡ�����еμ���������

B. ��һ������H2SO4��MgSO4�����Һ�еμ�����������Һ

C. ��������״MgCO3��MgO��ĩ�ֱ������ͬ��������ͬ����������ϡ������
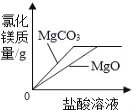
D. ��һ���¶��£����͵���������Һ�в��ϼ��������ƹ��壬��ֽ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K2Cr2O7��Һ�д���ƽ��: Cr2O72��(��ɫ)+H2O![]() 2CrO42��(��ɫ)+2H+����K2Cr2O7��Һ��������ʵ��:
2CrO42��(��ɫ)+2H+����K2Cr2O7��Һ��������ʵ��:

��1����K2Cr2O7��Һ�м���30% NaOH��Һ����Һ��________ɫ����Ϊ________________��
��2�������Ѽ���NaOH��Һ��(1)���ټ������ϡ���ᣬ����Һ��________ɫ����Ϊ____________________________________________________��
��3����K2Cr2O7��Һ����μ���Ba(NO3)2��Һ(��֪BaCrO4Ϊ��ɫ����)����ƽ������_________�����ƶ�����Һ��ɫ�仯Ϊ____________��
��4���ԱȢںܿ͢ɵó��Ľ�����______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������о���Ա������ú��������Ȼ�ѧѭ��ʵ��̫���ܵ�ת����洢���������£�

��1����Ӧ��2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ��H1=+551kJmol-1
��Ӧ��S(g)+O2(g)=SO2(g) ��H3=-297kJmol-1
��Ӧ����Ȼ�ѧ����ʽ��____________________��
��2���Է�Ӧ����ijһͶ�ϱ�ʱ������ѹǿ�£�H2SO4��ƽ����ϵ�����ʵ����������¶ȵı仯��ϵ����ͼ��ʾ��p2______p1����������������ó��ý��۵�������__________��

��3��I-������Ϊˮ��Һ��SO2�绯��Ӧ�Ĵ��������ܵĴ��������£���ii��������
i��SO2+4I-+4H+=S��+2I2+2H2O
ii��I2+2H2O+______=______+______+2I-
��4��̽��i��ii��Ӧ������SO2�绯��Ӧ���ʵĹ�ϵ��ʵ�����£��ֱ�18 mLSO2������Һ���뵽2mL�����Լ��У��ܱշ��ù۲�������֪��I2���ܽ���KI��Һ�У�
��� | A | B | C | D |
�Լ���� | 0.4molL-1 KI | amolL-1 KI 0.2molL-1H2SO4 | 0.2molL-1H2SO4 | 0.2molL-1 KI 0.0002 molI2 |
ʵ������ | ��Һ��ƣ�һ��ʱ�����ֻ��� | ��Һ��ƣ����ֻ��ǽ�A�� | ������������ | ��Һ���غ�ɫ�ܿ���ɫ����ɻ�ɫ�����ֻ��ǽ�A�� |
�� B��A�ĶԱ�ʵ�飬��a=______��
�ڱȽ�A��B��C���ɵó��Ľ�����______��
��ʵ�������SO2���绯��Ӧ����D��A�����i��ii��Ӧ���ʽ���ԭ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��������������ǵ�˵��������ǣ� ����
A.���ߵķ���ʽ��ͬ����������ѧԪ����ͬ
B.������ˮ�⣬�����Dz���ˮ��
C.����Ϊͬ���칹��
D.�������ǵ��ǣ��ܷ���������Ӧ��������˫�ǣ����ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȼ��2.24L(��״��)CO��O2�Ļ������ʱ���ų�11.32kJ����������������ܶ�Ϊԭ�������ܶȵ�1.25������CO��ȼ����Ϊ
A. 283 kJ��mol-1 B. -283 kJ��mol-1 C. -566 kJ��mol-1 D. 566kJ��mol-1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com