
���� ��1����ԭ��O2 Ϊ1 mol������ת�������������ɵij��������ʵ�������������ʣ������������ʵ���������ƽ��Ħ���������㣻
��2�����ݲ�������������������
��3��n��������壩=$\frac{0.896L}{22.4L/mol}$=0.04��mol������������������Ϊa��������ԭ���غ������ԭ���غ���⣻
��4��ij���۽������Ȼ����к���0.2mol Cl-�����Ȼ�������ʵ���Ϊ0.1mol��Ȼ�����M=$\frac{m}{M}$��������Ȼ����Ħ��������
��� �⣺��1����ԭ��O2 1 mol��������Ӧ��O2Ϊ1 mol��30%=0.3 mol���ɷ�Ӧ3O2$\frac{\underline{\;�ŵ�\;}}{\;}$2O3֪�����ɵ�O3Ϊ0.2 mol���ʷ�Ӧ����������Ϊ0.2 mol O3��O2Ϊ��1-0.3��mol=0.7 mol����ƽ��Ħ������=$\frac{0.7mol��32g/mol+0.2mol��48g/mol}{0.7mol+0.2mol}$=35.6 g/mol��
�ʴ�Ϊ��35.6��
��2��3O2$\frac{\underline{\;�ŵ�\;}}{\;}$2O3 ��V
2 1
V��O3�� ��8-6.5��L=1.5L
����V��O3��=2��1.5 L=3 L���ʴ�Ϊ��3��
��3��n��������壩=$\frac{0.896L}{22.4L/mol}$=0.04��mol������������������Ϊa��������ԭ���غ㣬0.04mol��a��3+0.04mol����1-a����2=$\frac{21.6-20}{16}$mol�����a=0.5��
�ʴ�Ϊ��0.5��
��4��9.5gij���۽������Ȼ����к���0.2mol Cl-�����Ȼ�������ʵ���Ϊ��0.2mol��$\frac{1}{2}$=0.1mol������Ȼ����Ħ������Ϊ��$\frac{9.5g}{0.1mol}$=95g/mol��
�ʴ�Ϊ��95g/mol��
���� ���⿼��ѧ�����ݷ���ʽ�ļ��㣬�Ѷ��еȣ�ע�⣨2�������ò��������м��㣬���Լ��㣬�ϳ��淽�����ۼ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
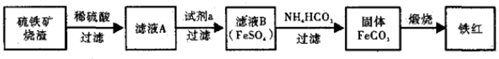
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
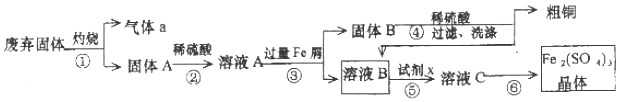
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 26.3 | B�� | 13.2 | C�� | 19.8 | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.7g���������������ʱʧȥ�ĵ�����ĿΪ0.1NA ����ʾ��M��Al��=27g/mol�� | |
| B�� | 17g���������ĵ�����ĿΪ10NA ����ʾ��M��NH3��=17g/mol�� | |
| C�� | 2g��������ԭ����ĿΪNA ����ʾ��M��H2��=2g/mol�� | |
| D�� | ���³�ѹ�£�11.2L����������ԭ����ĿΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������������������������� | |
| B�� | �ᴿ���е���Ȼ�泥����������� | |
| C�� | ��ȥ̼�����е�����̼�����ƣ����ü��ȷ� | |
| D�� | ��ȥCO2�е�SO2��ͨ��ʢ����ˮ��ϴ��ƿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢۢ٢ݢ� | B�� | �٢ڢۢݢ� | C�� | �ۢ٢ڢܢ� | D�� | �٢ݢڢۢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com