
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2 :1,三个氯离子位于外界。请根据以上情况,回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)B的氢化物分子的空间构型是________,其中心原子采取________杂化。
(3)写出化合物AC2的电子式________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为______________。
(4)E的核外电子排布式是________,ECl3形成的配合物的化学式为________。
【答案】 C<O<N 三角锥形 sp3 ![]() N2O 1s22s22p63s23p63d54s1(或[Ar]3d54s1) [Cr(NH3)4(H2O)2]Cl3
N2O 1s22s22p63s23p63d54s1(或[Ar]3d54s1) [Cr(NH3)4(H2O)2]Cl3
【解析】根据D、C形成DC离子晶体,且D、C都为二价离子,A、B、C为同一周期的非金属元素,所以D可能为Mg或Ca,C可能为O或S。又因为B、C的氢化物比同族相邻周期元素氢化物的沸点高,所以B、C的氢化物一定能形成氢键,且核电荷数A<B<C<D<E,所以B为N,C为O,D为Mg,E的原子序数为24,所以E为Cr,AC2为非极性分子,所以A为碳。(2)B的氢化物为NH3,空间构型为三角锥形,中心原子是sp3杂化;(3)AC2为CO2,其电子式为![]() ,N与O形成和CO2互为等电子体的物质应为N2O;(4)Cr的电子排布式为[Ar]3d54s1,根据信息,ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3。
,N与O形成和CO2互为等电子体的物质应为N2O;(4)Cr的电子排布式为[Ar]3d54s1,根据信息,ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞结构如图所示,(![]() )X位于立方体的顶点,(○)Y位于立方体的中心,试分析:
)X位于立方体的顶点,(○)Y位于立方体的中心,试分析:

(1)晶体中每个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体的化学式为________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角∠XYX=________(填角的度数)。
(4)若该立方体的棱长为a cm,晶体密度为ρ g·cm-3,NA为阿伏加德罗常数,则该离子化合物的摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的价类二维图,其中的箭头 表示部分物质间的转化关系,下列说法正确的是( )
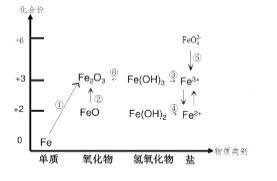
A. 铁与高温水蒸气的反应可实现上述转化①
B. FeO 是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末
C. 由图可预测:高铁酸盐( FeO42- )具有强氧化性,可用于消毒。FeO42- 与水反应最终可生成 Fe(OH)3胶体,从而吸附水中的悬浮物,故高铁酸盐可用做净水剂
D. 加热 Fe(OH)3 发生转化⑥,加水溶解可实现转化③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,B与C能层数相同,D与E能层数相同,C与D价电子结构相同,基态时B、C、D原子核外皆有2个未成对电子,A、E只有1个未成对电子,A能分别与B、C、D、E形成不同的分子。
(1)写出基态时B的价电子排布图 ,E—的原子结构示意图 。
(2)写出BCD的电子式 ,E2C的结构式 。
(3)根据题目要求完成以下填空:
EC3—中心原子杂化方式 ;DC3中心原子杂化方式 ;
EC4—微粒中的键角 ;BC32—微粒的键角 ;
DE2分子的立体构型 ;B2A2分子的立体构型 。
(4)一种由A、B、C三种元素组成的分子A2BC2,该分子中σ键数目为 ,π键数目为 。
(5)根据等电子原理,指出与BC2互为等电子体的离子 (一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:
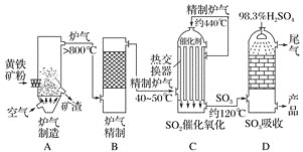
请回答下列问题:
(1)在炉气制造中,黄铁矿粉碎的目的是____________,生成二氧化硫的化学方程式是_____________。
(2)炉气精制的目的是__________________________________。
(3)二氧化硫催化氧化的化学方程式是________________________。
(4)浓硫酸是不是可以用水代替:__________,原因是__________________________________。
(5)尾气的主要成分是__________,若将尾气通入氢氧化钙浊液中,最后能得到的副产品是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_______________(用离子方程式表示)。已知AlF![]() 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,其单质及合金在生产生活中应用日趋广泛。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3杂质,SiO2在“碱溶”时转化为铝硅酸钠沉淀)为原料制备铝的一种工艺流程如下:
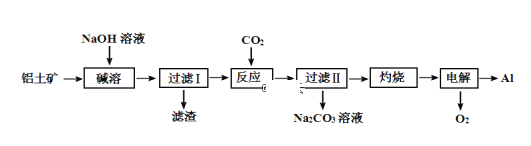
(1)“过滤Ⅰ”时滤渣的主要成分为 ______________ 、______________。
(2)“碱溶”时生成偏铝酸钠的离子方程式为____________________________。
(3)“反应”时,也可以用NaHCO3代替CO2,写出加入NaHCO3溶液后的离子方程式________________。
(4)“电解”时加入冰晶石的作用是___________________________________。
(5)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气存在下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_________________。
②1mol镁铝合金(Mg17Al12)分别与足量的盐酸、氢氧化钠溶液充分反应,生成的氢气在相同条件下的体积比为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com