
【题目】按要求写出下列物质的结构简式:
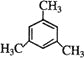
(1)写出与环辛四烯![]() 互为同分异构体且属于芳香烃的分子的结构简式:___。
互为同分异构体且属于芳香烃的分子的结构简式:___。
(2)写出与苯互为同系物且一氯代物只有一种的物质的结构简式(仅写两种支链数不同且支链 数小于4的物质):___、___。
(3)某烷烃A蒸气的密度是相同状况下氢气密度的64倍,经测定得知A分子中共含有6个甲基。
①若A不可能是氢气与烯烃加成的产物,A的结构简式为___;
②若A是炔烃与氢气加成的产物,A的结构简式是___。
【答案】![]()
![]()
【解析】
⑴环辛四烯![]() ,分子式为C8H8,属于芳香烃的分子即含有苯环,互为同分异构体的芳香烃的结构简式:
,分子式为C8H8,属于芳香烃的分子即含有苯环,互为同分异构体的芳香烃的结构简式:![]() ,
,
故答案为:![]() ;
;
⑵写出与苯互为同系物且一氯代物只有一种的物质的结构简式,从题意得出要写出有对称性的结构,如果支链为甲基,有对称性且只有一种一氯代物,则要再对位,即![]() ,如果有三个支链,则三个甲基在间位,
,如果有三个支链,则三个甲基在间位, ,
,
故答案为:![]() ;
; ;
;
⑶某烷烃A蒸气的密度是相同状况下氢气密度的64倍,即A的相对分子质量为128,因此得出烷烃分子式为C9H20,经测定得知A分子中共含有6个甲基,
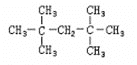
①若A不可能是氢气与烯烃加成的产物,A的结构简式为 ,
,
故答案为: ;
;
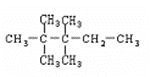
②若A是炔烃与氢气加成的产物,含有碳碳三键,则A的结构简式是 ,
,
故答案为: 。
。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0Lc mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
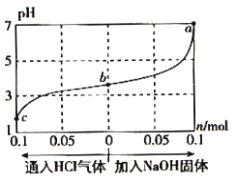
A.水的电离程度:a>b>c
B.b点对应的混合溶液中:c(Na+)<c(CH3COO-)
C.c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
D.该温度下,a、b、c三点CH3COOH的电离平衡常数均为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图为原电池装置示意图。
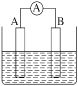
(1)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,写出B电极反应式:__。该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”),若该电池反应消耗了0.1molH2SO4,则转移电子的数目为__。
(2)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:___。该电池在工作一段时间后,溶液的碱性将___(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向
时,向![]() 溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述不正确的是
溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述不正确的是![]()

A.C点溶液中含有![]() 和
和![]()
B.![]() 溶液中水的电离程度比
溶液中水的电离程度比![]() 溶液中小
溶液中小
C.B点,![]()
D.D点,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物有着十分重要的用途:如氨基乙酸铜[结构简式为(H2NCH2COO)2Cu]常用作食品补铜剂及矿物元素饲料添加剂,硒化铜纳米晶在光电转化中有着广泛地应用;硫酸铜可用作配制农药等。
(1)基态硒原子的电子排布式为____,基态氮原子电子的空间运动状态有__种,与硒同周期相邻的三种元素第一电离能由大到小的顺序为______
(2)(H2NCH2COO)2Cu氨基乙酸铜中,碳原子的杂化轨道类型是______;与氮原子成键的原子(含氮原子本身)形成的空间构型是__________。
(3)硫酸铜晶体的组成可表示为[Cu(H2O)4]SO4·H2O,实验测得该物质中存在氢键且水分子成“键”情况与冰中类似,则1mol[Cu(H2O)4]SO4·H2O中氢键数目为__NA。
(4)硫酸铜在高温下分解有可能得到CuO、Cu2O、SO2、SO3等物质,其中CuO的熔点为1026℃。
①CuO的晶体类型是_____,熔点Cu2O>Cu2S的原因是______
②SO2与SO3中,属于非极性分子的是__,SO2在溶剂水与溶剂CCl4中,相同温度能溶解更多SO2的溶剂是___________
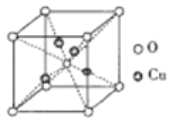
③铜的某种氧化物的晶胞如下图所示,则该氧化物的化学式为_______,若组成粒子氧、铜的半径分别为rOpm、rCupm,密度ρg/cm3,阿伏加德罗常数值为NA,则该晶胞的空间利用率为______(用含π的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,一定量的
时,一定量的![]() 与盐酸混合所得溶液中,部分含碳微粒的物质的量分数
与盐酸混合所得溶液中,部分含碳微粒的物质的量分数![]() 与pH的关系如图所示。下列说法正确的是
与pH的关系如图所示。下列说法正确的是
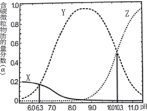
A.曲线X表示的微粒为![]()
B.![]() 时,
时,![]()
C.![]() 时,
时,![]()
D.![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时将 ![]() 氨水滴入
氨水滴入 ![]() 盐酸中,溶液 pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
盐酸中,溶液 pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A.![]()
B.水的电离程度:![]()
C.c点:![]()
D.d点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下列材料,完成下列小题。
戴维发现Cl2的反应为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O。多余的Cl2可用NaOH溶液吸收。液氯用于自来水消毒已成为目前给水系统中最为经济有效的消毒技术,但其消毒后生成的副产物对人体存在健康隐患。ClO2是一种易溶于水的气体,是国际上公认的高效、安全、无毒的绿色消毒剂。
MnCl2+Cl2↑+2H2O。多余的Cl2可用NaOH溶液吸收。液氯用于自来水消毒已成为目前给水系统中最为经济有效的消毒技术,但其消毒后生成的副产物对人体存在健康隐患。ClO2是一种易溶于水的气体,是国际上公认的高效、安全、无毒的绿色消毒剂。
【1】戴维发现Cl2的反应中,还原剂是
A.MnO2B.HClC.MnCl2D.Cl2
【2】从氧化还原反应的角度分析,下列物质中不可以替代MnO2的是
A.O2B.NaClO3C.NaClOD.NaCl
【3】Cl2被NaOH溶液吸收时会生成NaClO。NaClO属于
A.酸B.碱C.盐D.氧化物
【4】下列物质中可以替代NaOH溶液吸收Cl2的是
A.石灰乳B.食盐水C.浓硫酸D.稀盐酸
【5】实验室收集ClO2可以采用的方法是
A.![]() B.
B.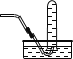 C.
C.![]() D.
D.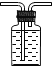
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为_____.
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____,B原子的杂化轨道类型是_____.
Li、B、H元素的电负性由大到小排列顺序为_____.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJmol﹣1 | I2/kJmol﹣1 | I3/kJmol﹣1 | I4/kJmol﹣1 | I5/kJmol﹣1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____(填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____,NaH的理论密度是___________gcm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com