
| A、Ag+、H+、Cl-、OH- |
| B、Na+、Ba2+、NO3-、CO32- |
| C、H+、Na+、CO32-、Cl- |
| D、K+、Cu2+、NO3-、SO42- |
科目:高中化学 来源: 题型:
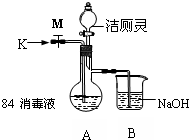
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极上产生0.025mol的O2 |
| B、电解过程中总共转移0.2mol的电子 |
| C、所得溶液中的C(H+)=0.3mol/L |
| D、阴极增重1.08g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
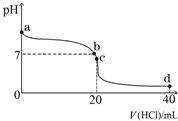 (1)有下列物质 ①Cu;②液氨;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦NH3?H2O;⑧NH4Cl属于弱电解质的是
(1)有下列物质 ①Cu;②液氨;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦NH3?H2O;⑧NH4Cl属于弱电解质的是| 化学式 | NH3?H2O | HCN | CH3COOH | H2CO3 |
| 电离平衡常数(25℃) | Kb=1.77×10-5 | Ka=4.93×10-10 | Ka=1.76×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2) |
| n(CO2) |

| A、该反应:△H>0 |
| B、氢碳比:①<②<③ |
| C、其它条件不变的情况下,缩小容器的体积可提高CO2的转化率 |
| D、若起始CO2浓度为2mol?L-1、H2为4mol?L-1,在图中曲线③氢碳比条件下进行,则400K时该反应的平衡常数数值约为1.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com