
| A. | 使用石蕊试纸检验气体需要现用蒸馏水湿润 | |
| B. | 使用容量瓶要先检查是否漏水 | |
| C. | 使用锥形瓶进行酸碱中和滴定要先用待测液润洗 | |
| D. | 使用棕色瓶保存浓硝酸 |
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 将足量SO2通入含Fe2+、Cl-、Ba2+、Al3+的溶液中,四种离子仍能大量共存 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 氢氧化铁与足量的HBr溶液反应的离子方程式:Fe(OH)2+3H+═Fe2++3H2O | |
| D. | 将100mL1mol•L-1的FeCl3溶液与足量NaS固体充分反应,生成沉淀10.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
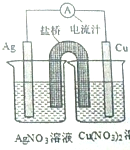 某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )
某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )| A. | 实验过程中,左右两侧烧杯中,NO3-浓度变化情况分别为不变,增大 | |
| B. | 实验过程中,取出盐桥,该原电池也能继续工作 | |
| C. | 若开始使用U形铜管代替盐桥,装置中有电流产生,铜管质量不变 | |
| D. | 若开始时用U形铜管代替盐桥,装置中无电流产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
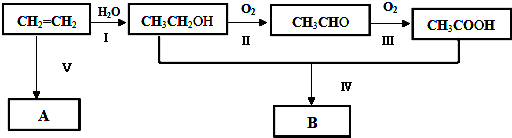
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H4=△H1+△H3-△H2 | B. | △H4=△H1+2△H3-△H2 | ||
| C. | △H4=△H2+△H1+2△H3 | D. | △H4=2(△H2-△H1+2△H3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应涉及到离子键和共价键的断裂与形成 | |
| B. | 该反应中,化学能只转变为热能 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量,小于形成1molH-Cl键所放出的能量 | |
| D. | 反应物所具有的总能量高于产物所具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
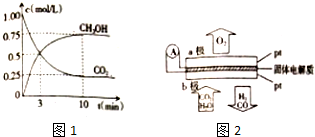
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 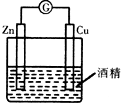 形成原电池 | B. | 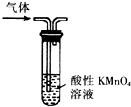 除去乙烯中混有的SO2 | ||
| C. | 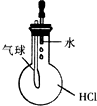 验证HCl气体在水中的溶解性 | D. | 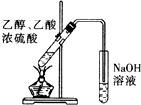 实验室制取乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com