
| ||
| ||
| 2 |
| 3 |
| 2 |
| 3 |


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
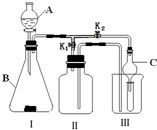 某研究性学习小组设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.
某研究性学习小组设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| A、先加BaCl2溶液有白色沉淀,再加稀盐酸沉淀不消失 |
| B、先加BaCl2溶液有白色沉淀,再加稀硝酸沉淀不消失 |
| C、先加Ba(NO3)2溶液有白色沉淀,再加稀盐酸沉淀不消失 |
| D、先加稀盐酸无明显现象,再加BaCl2溶液有白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4:7 | B、10:7 |
| C、14:11 | D、11:14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、每生成1mol Na2H3IO6转移2mol电子 |
| B、碱性条件下,NaIO3的氧化性强于Na2H3IO6 |
| C、该反应中Cl2做还原剂 |
| D、氧化产物与还原产物的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当V=0时,[OH-]=[H+]+[HCO3-]+2[H2CO3] |
| B、当V=5时,[Na+]+[H+]=2[CO32-]+[HCO3-]+[OH-] |
| C、当V=10时,[Cl-]=[CO32-]+[HCO3-]+[H2CO3] |
| D、当V=15时,[Na+]=[Cl-]>[HCO3-]>[OH-]>[H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:
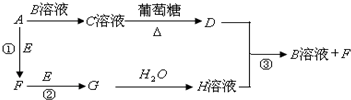
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com