
NA表示阿伏加罗常数的值,下列有关叙述正确的个数为
①1mol苯乙烯中含有的碳碳双键数为4NA
②4.2g乙烯和丙烯混合气中含有的极性键数目为0.6NA
③标况下,3.36LHF含有的电子数为1.5NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6gNO2和N2O4混合气体中所含原子总数为0.3NA
⑥在KClO3+6HCl(浓)=KCl+3Cl2+3H2O反应中,每生成1mol Cl2转移的电子总数为2 NA
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8g Fe与足量水蒸气完全反应失去0.8NA个电子.
A.3个 B.4个 C.5个 D.6个
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年辽宁葫芦岛一中等五校高二6月联考化学卷(解析版) 题型:实验题
锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1. | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该滤渣1所涉及的离子方程式为 、 。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+):c(Ni2+)= 。
(5)将质量为akg的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为  。(用含a、b、c的式子表达,无需化简)
。(用含a、b、c的式子表达,无需化简)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高一下第六次半月考化学卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数,则下列叙述正确的是( )
A.在20 g H218O中含有10NA个中子
B.标准状况下,22.4 L CCl4含有NA个CCl4分子
C.1 mol羟基(-OH)含有10NA个电子
D.1 mol乙醇分子中含有共用电子对数目为7NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高一6月月考化学试卷(解析版) 题型:选择题
下列物质中,不能和氯气发生取代反应的是
A.CH3Cl B.CCl4 C.CH2Cl2 D.CH4
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三三模理综化学试卷(解析版) 题型:选择题
研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是
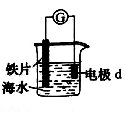
A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀,该防护方法属于牺牲阳极的阴极保护法。
D.d为锌块,铁片上电极反应为:2H+ + 2e → H2↑
2e → H2↑
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三下仿真二理综化学试卷(解析版) 题型:填空题
氮的化合物在生产生活中广泛存在。
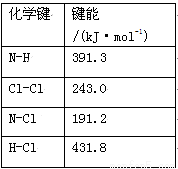
(1)①氯 胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)  N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况
N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况 如下表所示:
如下表所示:
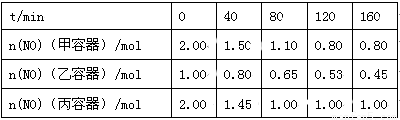
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安长安一中高二下第二次月考化学卷(解析版) 题型:实验题
实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
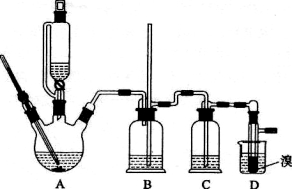
有关数据列表如下:
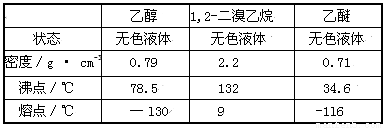
回答下列问题:
(1)写出该实验过程中 发生的所有主要反应的化学方程式__________________________.
发生的所有主要反应的化学方程式__________________________.
(2)在此制各实验中,要尽可能迅速地把反应温度170℃左右,其最主要目的是 ____.
(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是 (填实验现象).
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_______层
(6)若产物中有少量未反应的Br2,最好用 洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚.可用 的方法除去.
(8)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下第三次考试化学试卷(解析版) 题型:选择题
下列反应不可能作为原电池工作时发生的反应的是
A.Cu+2AgNO3=Cu(NO3)2+2Ag B.2Fe+O2+2H2O=2Fe(OH)2
C.NaOH+HCl=NaCl+H2O D.2H2+O2=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com