
【题目】下列粒子在化学反应中容易得到电子的是( )
A.  B.
B.  C.
C.  D.
D. 
【答案】D
【解析】
原子都有达到稳定结构的趋势,最外层电子数越多越容易得到电子(除稀有气体外),从而达到8电子的稳定结构,非金属性就越强;最外层电子数越小越容易失去电子,金属性越强,据此答题。
A.该原子的最外层已达8个电子,结构比较稳定,化学性质不活泼,故不易得失电子,故A不选;
B.该原子的最外层有1个电子,在化学反应中易失去1个电子而达8电子的稳定结构,故B不选;
C.该原子的最外层有2个电子,在化学反应中易失去2个电子而达8电子的稳定结构,故C不选;
D.该原子的最外层有7个电子,最外层电子数越多越容易得到电子(除稀有气体外),在化学反应中易得到1个电子而达8电子的稳定结构,故D选。
故选D。


科目:高中化学 来源: 题型:
【题目】有关乙烯的下列叙述:①乙烯溶于水后可得乙醇 ②乙烯燃烧时发出淡蓝色火焰 ③乙烯能与溴水发生加成反应 ④乙烯是无色、稍有气味、难溶于水的气体;正确的是
A. ③④ B. ①③ C. ②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”——钛酸钡(BaTiO3)的工艺流程如下:
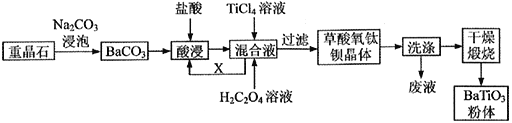
查阅资料可知:
①常温下: Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9
②TiC14在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O。
请回答下列问题:
(1)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为___________,此反应的平衡常数K=____ (填写计算结果)。若不考虑CO32- 的水解,则至少需要使用_____mol/L 的Na2CO3溶液浸泡重晶石才能实现该转化过程。
(2)酸浸时所发生反应的离子方程式为___________________________________。
(3)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_____________________。
(4)可循环使用的物质X 是_________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_____________________________________________________________。
(5)煅烧草酸氧钛钡晶体得到BaTiO3的同时,高温下生成的气体产物有CO、__________和_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如下图,则下列说法正确的是( )

A. a点时溶液pH=11.5,原因是:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. a-b段发生反应为:CO32-+2H+ = CO2↑+H2O
C. b-c段发生反应为:HCO3-+H+ = CO2↑+H2O
D. c-d段发生反应为:H++OH- = H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列短周期元素性质的数据判断,下列说法正确的是( )
|
|
|
|
|
|
|
| |
原子半径 |
|
|
|
|
|
|
|
|
最高价或最低价 |
|
|
|
|
|
|
|
|
A. 元素④⑤形成的化合物是离子化合物
B. 元素⑦位于第二周期第V族
C. 元素①⑧形成的化合物具有两性
D. 元素③的最高价氧化物对应水化物的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是
① ②
②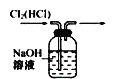
③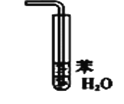 ④
④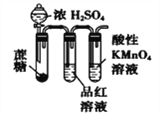
A. 用图①所示装置分离Na2CO3溶液和CH3COOC2H5的混合物
B. 装置②可用于除去Cl2中的HCl
C. 装置③可用于氯化氢气体溶于水
D. 装置④:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅直至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeS 与一定浓度的HNO3 反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1:1:2 时,实际参加反应的FeS 与被还原的HNO3的物质的量之比为 ( )
A. 1:4 B. 1:5 C. 1:6 D. 1:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )

A. 紫色石蕊溶液先变红后褪色B. 品红溶液褪色
C. 溴水橙色褪去D. 含酚酞的NaOH溶液红色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com