
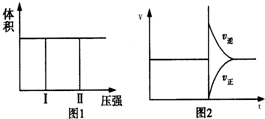
| A. | 若把2molX和1 molY充入该容器时,处于状 态Ⅰ,达到平衡时处于状态Ⅱ(如图1所示),则该反应的正反应是吸热反应 | |
| B. | 若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,Z的物质的量仍为 p mol,则W的起始物质的量n(W)应满足的条件是n(W)>(1-0.5p) mol | |
| C. | 反应达到平衡后,再将2molX和1 molY充入该容器中,则反应速率V与时间t关系图如图2所示 | |
| D. | 若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的密度未发生改变 |
分析 A、若把2mol A和1mol B充入该容器时,处于状态Ⅰ,达到平衡时处于状态Ⅱ,分析图象可知,变化过程中随压强增大,气体体积不变,说明D变化为气体,反应放热;
B、2X(g)+Y(g)═2Z(g)+W(s),
起始量 2 1 0 0
变化量 p 0.5p p 0.5p
平衡量 2-p 1-0.5p p 0.5p
逆向进行达到相同平衡状态,设W起始量为x
2X(g)+Y(g)═2Z(g)+W(s),
起始量 0 0 2 x
变化量 2-p 1-0.5p 2-p 1-0.5p
平衡量 2-p 1-0.5p p 0.5p
固体对化学平衡无影响;
C、反应达到平衡后,再将2molX和1 molY充入该容器中,反应物浓度增大,反应速率都增大,瞬间正反应速率增大,逆反应速率不变;
D、生成物W为固体,平衡移动,气体质量发生变化,容器体积不变,所以减低温度平衡移动发生移动,气体质量移动发生变化,密度ρ=$\frac{m}{V}$分析判断.
解答 解:A、体积不变,压强增大,说明温度升高,该反应是个放热反应,若把2molX和1 molY充入该容器时,处于状 态Ⅰ,达到平衡时处于状态Ⅱ(如图1所示),则该反应的正反应是吸热反应,故A错误;
B、2X(g)+Y(g)═2Z(g)+W(s),
起始量 2 1 0 0
变化量 p 0.5p p 0.5p
平衡量 2-p 1-0.5p p 0.5p
逆向进行达到相同平衡状态,设W起始量为x
2X(g)+Y(g)═2Z(g)+W(s),
起始量 0 0 2 x
变化量 2-p 1-0.5p 2-p 1-0.5p
平衡量 2-p 1-0.5p p 0.5p
固体对化学平衡物影响,从生成物开始配比,要求达到平衡时,Z的物质的量仍为 p mol,则W的起始物质的量n(W)应满足的条件是n(W)>(1-0.5p) mol,故B正确;
C、反应达到平衡后,再将2molX和1 molY充入该容器中,反应物浓度增大,反应速率都增大,瞬间正反应速率增大,逆反应速率不变,图象中反应是逆向进行,故C错误;
D、生成物W为固体,平衡移动,气体质量发生变化,容器体积不变,所以减低温度平衡移动发生移动,气体质量移动发生变化,密度ρ=$\frac{m}{V}$分析,若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的密度发生改变,故D错误;
故选B.
点评 本题考查了化学平衡的计算和平衡移动原理的影响因素分析判断,注意等效平衡状态的理解应用,图象的分析方法是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在研究物质微观结构的过程中,科学家先后使用了扫描隧道显微镜、光学显微镜、电子显微镜等观测仪器 | |
| B. | “纳米铜”具有非常强的化学活性,在空气中可以燃烧,因为它比铜片更易失去电子 | |
| C. | 室温离子液体是指在室温或接近室温下呈现的完全由阴、阳离子所组成的盐,(C2H5NH3)NO3可能是其中一种 | |
| D. | 肼、氨、甲醇燃料电池的热值远高于燃料普通燃烧的热值 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M+N=Q+R | B. | M+2N=2R+Q | C. | 2M+N=2R+Q | D. | 2M+N=R+2Q |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 共价键 | H-H | C-H | C-O | O-H |
| 键能(kJ-mol-3) | 436 | 414 | 326 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4、C6H6 | B. | CH4、CH2O | C. | C3H8、CH3CH2OH | D. | C2H6、CH3CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com