
化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质 | 实际应用 | |
A. | 三价铁比二价铜氧化性强 | FeCl3腐蚀Cu刻制印刷电路板 |
B. | HF能与Si反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
C. | 次氯酸盐具有氧化性 | 次氯酸钙可做漂白剂 |
D. | 稀硝酸可与银反应 | 稀硝酸可除去试管内壁的银镜 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年广东实验中学顺德学校高二上阶段质检化学试卷(解析版) 题型:选择题
已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol, 蒸发1mol Br2(l)需要吸收的能量为30kJ,
其它相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1mol分子中的化学键断裂时需要吸收的能量/KJ | 436 | a | 369 |
则表中a为 ( )
A.404 B.260 C.230 D.200
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上第一次月考化学试卷(解析版) 题型:选择题
T℃时,体积均为0.5 L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g) 2C(g) △H= -Q kJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
2C(g) △H= -Q kJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 0.75Q kJ |
② | 0.4 | 0.2 | 1.6 | |
下列叙述中正确的是
A.容器①、②中反应的平衡常数均为18
B.容器②中达到平衡时放出的热量为0.05Q kJ
C.向容器①中通入氦气,平衡时A的转化率变大
D.其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市如东县徐州市丰县高三10月联考化学卷(解析版) 题型:填空题
危化仓库中往往存有钠、钾、液氯、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题:
(1)钠、钾都为活泼金属,在空气中着火时会剧烈燃烧。若金属Na着火,应用 来扑(盖)灭。
(2)氯气是一种黄绿色的有毒气体,工业上常用NH3来检验氯气是否发生泄漏,检验时若产生白烟,证明氯气发生了泄漏,则白烟的主要成份是 。(填化学式)写出产生白烟化学方程式 。
(3)NH4NO3为爆炸物,在某温度下按下式进行分【解析】
5NH4NO3═4N2↑+2HNO3+9H2O,则被氧化和被还原的氮元素质量之比为 。
(4)硫酸铜溶液是白磷引起中毒的一种解毒剂:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 mol。
(5)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出离子反应方程式: 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市如东县徐州市丰县高三10月联考化学卷(解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.c(H+)/c(OH?)=1的无色溶液中:Fe3+、NH4+、Cl?、SO42?
B.使甲基橙呈黄色的溶液中:Na+、ClO?、SO42?、I?
C.0.1 mol·L-1NaAlO2溶液:H+、Na+、Cl-、SO42-
D. pH=12的溶液:K+、Na+、CH3COO-、Br-
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三联合考试化学试卷(解析版) 题型:填空题
氨和联氨(N2H4)既是一种工业原料,又是一种重要的工业产品。
(1)实验室可用氯化铵与消石灰反应制取氨气,其反应的化学方程式为 。
(2)联氨在一定条件下可按下式分【解析】
3N2H4(g)=N2(g)+4NH3(g),已知断裂1molN—H、N—N及N≡N需吸收的能量依次为390.8kJ、193kJ、946kJ。若生成1molN2,则反应 (填“放出”或“吸收”) kJ的能量。
(3)NH3—O2燃料电池的结构如图所示。
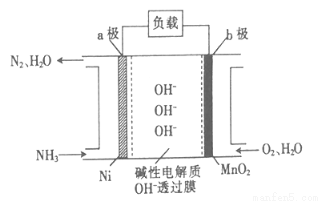
①a极为电池的 (填“正”或“负”)极。
②当生成1molN2时,电路中流过电子的物质的量为 。
(4)联氨可以高效地脱除烟道气中的NO从而生成N2,该反应中氧化产物与还原产物的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三联合考试化学试卷(解析版) 题型:选择题
下列实验中,对应的现象以及结论都正确的是
选项 | 实验 | 现象 | 结论 |
A | 向酸性KMnO4溶液中滴加H2O2溶液至过量 | 紫色消失 | H2O2在该反应中作还原剂 |
B | 溶有SO2的BaCl2溶液中通入气体X | 有白色沉淀生成 | X一定是Cl2 |
C | 向FeBr2和KSCN混合溶液中滴入少量新制氯水,再加入CCl4混合振荡、静置 | 有机相呈红棕色,水相呈无色 | Fe2+的还原性大于Br- |
D | 铝丝用砂纸打磨后,放在冷的浓硝酸中浸泡一段时间后,放入CuSO4溶液中 | 铝丝表面变红色 | 铝可从铜盐溶液中置换出铜 |
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:选择题
下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式正确的是()
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Fe2+、NO3-、NH4+ | NaHSO4溶液 | 3Fe2++NO3- +4H+=3 |
B | Ca2+、HCO3-、Cl- | 少量NaOH溶液 | Ca2++2HCO3- +2OH-=2H2O+CaCO3↓+CO32- |
C | K+、AlO2-、HCO3- --来源:Zxxk.Com] | 通入少量CO2 | 2Al |
D | NH4+、Al3+、SO42- | 少量Ba (OH) 2溶液 | 2NH4+ |
A.A B.B C. C D.D
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
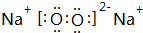
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com