
【题目】将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加人3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。则下列叙述中不正确的是 ( )
A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mI。
B.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
C.参加反应的金属的总质量为9.6 g>m>3.6 g
D.当金属全部溶解时收集到NO气体的体积一定为2. 24 L
【答案】D
【解析】
试题分析:将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O;3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O;向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3;Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为![]() =0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol;A.若硝酸无剩余,则参加反应氢氧化钠的物质的量等于0.3mol,需要氢氧化钠溶液体积=
=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol;A.若硝酸无剩余,则参加反应氢氧化钠的物质的量等于0.3mol,需要氢氧化钠溶液体积=![]() =0.1L=100mL,硝酸若有剩余,消耗的氢氧化钠溶液体积大于100mL,故A正确;B.根据方程式可知参加反应的n反应(HNO3)=n(金属)=0.15mol×=0.4mol,故B正确;C.镁和铜的总的物质的量为0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为3.6g<m<9.6g,故C正确;D.镁和铜的总的物质的量为0.15mol,根据电子转移守恒可知生成的NO物质的量为
=0.1L=100mL,硝酸若有剩余,消耗的氢氧化钠溶液体积大于100mL,故A正确;B.根据方程式可知参加反应的n反应(HNO3)=n(金属)=0.15mol×=0.4mol,故B正确;C.镁和铜的总的物质的量为0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为3.6g<m<9.6g,故C正确;D.镁和铜的总的物质的量为0.15mol,根据电子转移守恒可知生成的NO物质的量为![]() =0.1mol,若为标准状况下,生成NO的体积为0.1mol×22.4L/mol=2.24L,但NO不一定处于标准状况,收集到NO气体的体积不一定为2.24L,故D错误;故选D。
=0.1mol,若为标准状况下,生成NO的体积为0.1mol×22.4L/mol=2.24L,但NO不一定处于标准状况,收集到NO气体的体积不一定为2.24L,故D错误;故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在元素周期表的金属元素和非金属元素交界处,最容易找到的材料是( )
A. 制半导体的材料
B. 耐高温、耐腐蚀的合金材料
C. 制农药的材料
D. 制催化剂的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验室用如图所示装置制取少量溴苯。请填写下列空白。

(1)在烧瓶a中装的试剂是苯、溴和铁屑。导管b的作用有两个:一是导气,二是兼起_______的作用。
(2)反应过程中在导管c的下口附近可以观察到白雾出现,这是由于反应生成的________遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色不溶于水的液体。这是溶解了溴的粗溴苯,可选用试剂 除去。
(5)写出烧瓶a中发生反应的化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:(除特别注明外,其它一律用化学式表示)
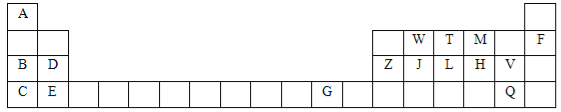
(1)化学性质最不活泼的单质是 ,最高价氧化物水化物中碱性最强的是 。
(2)J在周期表中的位置第 。
(3)某元素二价阳离子的核外有10个电子,该元素名称是 。
(4)M、H形成的气态氢化物的沸点比较: (用 > 连接)。
(5)写出工业合成T的气态氢化物的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。

(1)乙醇分子官能团名称是_______________。
(2)试管a中加入几块碎瓷片的目的是___________。
(3)试管a中发生反应的化学方程式为 ___________,反应类型是_______。
(4)可用_________的方法把制得的乙酸乙酯分离出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃有两种或两种以上的同分异构体.其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是
①分子中具有7个碳原子的芳香经;②分子中具有4个碳原子的烷经;③分子中具有12个氢原子的烷烃;④分子中具有8个碳原子的烷烃
A. ③④
B. ①②
C. ②③
D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油化工的重要原料,它主要通过石油产品裂解获得。
(1)石油产品裂解所得裂解气的平均组成可表示为CnHm(m>2n),经测定某裂解气中各气体的体积分数分别为:甲烷―4%、乙烯―50%、丙烯―10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到50 mol乙烯,x mol丁二烯和y mol氢气。则x+y= , n / m = (请用含x的式子表示)。(4分)
(2)某化工厂每天由石油产品裂解得到乙烯56 t。再以乙烯为主要原料生产醋酸乙烯酯,醋酸乙烯酯是合成维尼纶的重要单体。生产原理如下:

反应①中乙烯的利用率为80%,反应②中乙醛的利用率为83.33%,反应③中乙酸与乙烯的利用率均为85%。则该厂每天最多可制得醋酸乙烯酯多少吨?(8分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们常用空气污染指数API(Air Pollution Index)来表示空气的质量。某地区各种污染指数分别为:二氧化硫95,二氧化氮48,可吸入颗粒物55。则该地区的空气污染指数为( )
A.48 B.55 C.95 D.198
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu 64)。
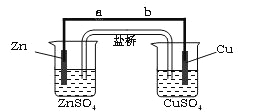
按照实验步骤依次回答下列问题:
(1)导线中电子流向为 (用a、b 表示)。
(2) 写出装置中锌电极上的电极反应式: ;
(3)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;(不许用“NA”表示 )
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+,Cl-的移动方向描述正确的是 。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B.Zn C.Fe D.H2SO4
(6)反应一段时间后右侧烧杯中Cu2+浓度是 (填增大 减小或不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com